
【题目】呋喃酚是生产呋喃丹、好安威等农药的主要中间体,是高附加值的精细化工产品。一种以邻氯苯酚(A)为主要原料合成呋喃酚(F)的流程如下:

回答下列问题:
(1)A物质核磁共振氢谱共有______个峰,④的反应类型是_______,C和D中含有的相同官能团的名称是________。
(2)下列试剂中,能和D反应的有__________(填标号)。
A.溴水 B.酸性K2Cr2O7溶液 C.FeCl2溶液 D.纯碱溶液
(3)写出反应①的化学方程式是__________(有机物用结构简式表示,下同)。
(4)有机物B可由异丁烷经三步反应合成:
![]()
条件a为________, Y 生成 B 的化学方程式为 _______。
(5)呋喃酚的同分异构体很多,写出符合下列条件的所有同分异构体的结构简式____ 。
①苯环上的一氯代物只有一种 ②能发生银镜反应的芳香酯
【答案】5 取代反应(或水解反应) 氯原子、碳碳双键 ABD 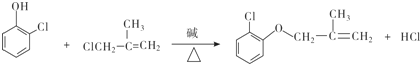 氢氧化钠的乙醇溶液、加热 CH2=C(CH3)2+Cl2
氢氧化钠的乙醇溶液、加热 CH2=C(CH3)2+Cl2![]() CH2=C(CH3)CH2Cl+HCl
CH2=C(CH3)CH2Cl+HCl 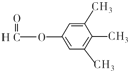 、
、
【解析】
A和B发生取代反应生成C,C在一定条件下转化为D,D发生分子内的加成反应生成E,E发生取代反应生成F,据此解答。
(1)根据A的结构简式 可知,A的核磁共振氢谱中峰的数目为5(
可知,A的核磁共振氢谱中峰的数目为5(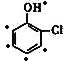 );比较E(
);比较E(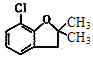 )和F(
)和F(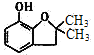 )的结构简式可知,E中的氯原子被羟基取代得到F,因此反应④为取代反应(或水解反应);根据C(
)的结构简式可知,E中的氯原子被羟基取代得到F,因此反应④为取代反应(或水解反应);根据C(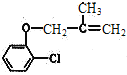 )和D(
)和D(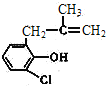 )的结构简式可知,C和D中都含有的官能团是氯原子和碳碳双键,故答案为:5;取代反应(或水解反应);氯原子、碳碳双键;
)的结构简式可知,C和D中都含有的官能团是氯原子和碳碳双键,故答案为:5;取代反应(或水解反应);氯原子、碳碳双键;
(2)D的结构简式为 ,D中有苯环和酚羟基、氯原子、碳碳双键,可以和溴水发生取代反应、加成反应,被酸性K2Cr2O7溶液氧化,能与纯碱溶液反应生成碳酸氢钠,故答案为:ABD;
,D中有苯环和酚羟基、氯原子、碳碳双键,可以和溴水发生取代反应、加成反应,被酸性K2Cr2O7溶液氧化,能与纯碱溶液反应生成碳酸氢钠,故答案为:ABD;
(3)根据元素守恒和C的结构可知,B为CH2=C(CH3)CH2Cl,所以反应①的化学反应方程式为 ,故答案为:
,故答案为: ;
;
(4)B为CH2=C(CH3)CH2Cl,CH3CH(CH3)2与氯气按1∶1发生取代反应生成X,X为CH2ClCH(CH3)2,X发生消去反应得Y,Y为CH2=C(CH3)2,反应条件a为氢氧化钠的乙醇溶液、加热,Y与氯气在500℃发生取代反应生成B,反应的方程式为CH2=C(CH3)2+Cl2 ![]() CH2=C(CH3)CH2Cl+HCl,故答案为:氢氧化钠的乙醇溶液、加热;CH2=C(CH3)2+Cl2
CH2=C(CH3)CH2Cl+HCl,故答案为:氢氧化钠的乙醇溶液、加热;CH2=C(CH3)2+Cl2 ![]() CH2=C(CH3
CH2=C(CH3
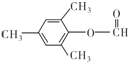
(5)呋喃酚( )的同分异构体符合下列条件:①苯环上的一氯代物只有一种,说明苯环上只有一种氢原子,②能发生银镜反应的芳香酯,说明含有甲酸形成的酯基,则符合条件的同分异构体有
)的同分异构体符合下列条件:①苯环上的一氯代物只有一种,说明苯环上只有一种氢原子,②能发生银镜反应的芳香酯,说明含有甲酸形成的酯基,则符合条件的同分异构体有 、
、 ,故答案为:
,故答案为: 、
、 。
。


科目:高中化学 来源: 题型:
【题目】碳酸氢钠是重要的化工产品。用标准盐酸溶液滴定可测定碳酸氢钠样品中碳酸氢钠含量。已知碳酸氢钠受热易分解,且在250℃~270℃分解完全。
完成下列填空:
(1)测定碳酸氢钠含量的实验步骤:用电子天平称取碳酸氢钠样品(准确到_____g),加入锥形瓶中,加入使之完全溶解;加入甲基橙指示剂,用标准盐酸溶液滴定。当滴定至溶液由_____色变为_____色,半分钟不变色为滴定终点,记录读数。该实验不能用酚酞作指示剂的原因是_____。
(2)若碳酸氢钠样品质量为0.840g,用0.5000mol/L的标准盐酸溶液滴定至终点,消耗标准盐酸溶液19.50mL。样品中NaHCO3的质量分数为_____(保留3位小数)。
(3)如果滴定尖嘴部分在滴定过程中出现气泡,且滴定终点读数时气泡未消失,会导致测定结果____(选填“偏高”、“偏低”或“不受影响”)。
(4)碳酸氢钠样品含有少量水分(<0.5%)和氯化钠。以下是测定碳酸氢钠样品中水分的实验方案(样品中NaHCO3含量已知)。
①在恒重的坩埚中称取碳酸氢钠样品,样品和坩埚的质量为m1g。
②将样品和坩埚置于电热炉内,在250℃~270℃加热分解至完全,经恒重,样品和坩埚的质量为m2g。
③……。
该实验方案中,质量差(m1-m2)是_____的质量。若所称取样品中NaHCO3的质量为m3g,则样品中水分的质量m=_____(用含m、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的影响如图所示,下列说法正确的是( )
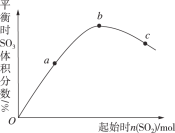
A.反应bc点均为平衡点,a点未达到平衡且向正反应方向进行
B.abc三点的平衡常数Kb>Kc>Ka
C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.abc三点中,a点时SO2的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与过量的锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___________________;并用简单的装置图来表明你所阐述的理由______________________________;
(2)要加快上述实验中气体产生的速率,还可采取的措施有_______________;
(3)下列物质的加入能减慢氢气生成速率但不影响生成氢气的体积的是_____
A.加入碳酸钠溶液 B.加入硫酸钠溶液
C.加入硝酸钠溶液 D.加入醋酸钠溶液
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液实验 | 1 | 2 | 3 | 4 | 5 | 6 |
4mol·mol-1H2SO4/mL | 40 | V1 | V2 | V3 | V4 | V5 |
饱和 CuSO4 溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V6、V8 分别是_____________;
②该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率会大大提高,随着加入的 CuSO4 溶液增多时,生成氢气的速率会______(填加快、减慢或不变)。理由___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
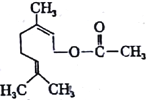
①1mol该有机物可消耗3molH2;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体中可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH
A. ②③⑤ B. ①④⑤ C. ①②③ D. ②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL、浓度均为0.1mol·L-1的氢氧化钠溶液、氨水中分别滴加0.1mol·L-1盐酸,溶液导电性如图所示(已知:溶液导电性与离子浓度相关)。下列说法正确的是

A.a点溶液pH=11
B.曲线1中c与e之间某点溶液呈中性
C.c点溶液中:c(H+)=c(OH-)+c(N3H·H2O)
D.在a、b、c、d、e中,水电离程度最大的点是d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,已知0.1molL﹣1HCl溶液中c(OH﹣)=1×10﹣11molL﹣1,现将0.2molL﹣1的硫酸氢钠和等浓度的氢氧化钡溶液等体积混合,充分反应后溶液的pH=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体![]() 的一种方案如下:
的一种方案如下:

下列说法不正确的是![]()
A.滤渣A的主要成分是![]()
B.“合成”反应要控制温,温度过高,产率会降低
C.“系列操作”包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等
D.相同条件下,![]() 净水能力比
净水能力比![]() 强
强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是( )

A.曲线I表示MnS的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点
C.常温下,反应MnS(s)+Fe2+(aq)![]() FeS(s)+Mn2+(aq)的平衡常数K≈4×104
FeS(s)+Mn2+(aq)的平衡常数K≈4×104
D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿工线向a点方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com