
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ��
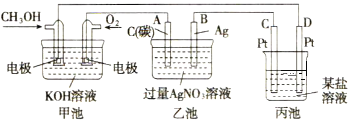
��1��ͼ�м׳���______װ��(��������������ԭ�����)������OH-����______��(����CH3OH������O2��)��
��2��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ��_______��
��3�����ҳ����缫�����ֱ�μ�������ɫʯ����Һ���������ĵ缫Ϊ________��(����A������B��)����д���˵缫�ķ�Ӧʽ_______��
��4���ҳ����ܷ�Ӧ�����ӷ���ʽ_________��
��5�������£����ҳ���B(Ag)������������5.40gʱ���ҳص�pH��_______(����ʱ�ҳ�����Һ�����Ϊ500mL)����ʱ����ij�缫����1.60gij����������е�ij����Һ������________(�����)��
A.MgSO4 B.CuSO4 C.NaCl D.KOH
���𰸡�ԭ��� CH3OH CH3OH-6e-+8OH-=CO32-+6H2O A 4H2O-4e-=O2��+4H+ 4Ag++2H2O=4Ag+O2��+4H+ 1 B
��������
(1)ȼ�ϵ������ԭ��أ�ԭ��طŵ�ʱ����Һ���������������ƶ������������ƶ���
(2)ȼ�ϵ����ȼ��ʧ���ӷ���������Ӧ���״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ��
(3)�ҳ�����ӵ�Դ�ǵ��أ�������ˮ�õ������������������ӣ������������ӷŵ磬������Һʹ��ɫʯ����Һ��죬���ݵ缫������Һ������Ա仯ȷ����Һ���ĵ缫��
(4)�����������Һʱ�������ӵõ�����������ˮʧ�������������������ӣ��ݴ�д�����ӷ���ʽ��
(5)�������������ӹ�ϵʽ����������Ũ�ȣ��Ӷ�ȷ����Һ��pH���������������������ڽ������˳����н���Ԫ�ش���HԪ�غ��ݴ��������ת�Ƶ��������֪��������������Ԫ����Ҫ�ĵ��ӵ��ڻ�С���ҳ���ת�Ƶ��������ݴ�ȷ�����еĽ���Ԫ�ء�
(1)ȼ�ϵ���ǻ�ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�ȼ�ϵ���У�Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫��������ԭ��طŵ�ʱ���������Һ���������������ƶ�������Ͷ�ż״��ĵ缫�ƶ����ʴ�Ϊ��ԭ��أ�CH3OH��
(2)��ȼ�ϵ���У��״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪ��CH3OH-6e-+8OH-=CO32-+6H2O���ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
(3)�ҳ�����ӵ�Դ���ڵ��أ�����ԭ���������A������������ԭ��ظ�����B�������������������Һʱ��A�缫��ˮ�õ������������������ӣ��缫��ӦʽΪ4H2O-4e-=O2��+4H+����Һ�����ԣ��μ���ɫʯ����Һ�ʺ�ɫ�� �ʴ�Ϊ��A��4H2O-4e-=O2��+4H+��
(4)�����������Һʱ�������ӵõ�����������ˮʧ�������������������ӣ����ӷ���ʽΪ4Ag++2H2O=4Ag+O2��+4H+���ʴ�Ϊ��4Ag++2H2O=4Ag+O2��+4H+��
(5)���ҳ���B(Ag)������������5.40gʱ����������Ũ��Ϊxmol/L��
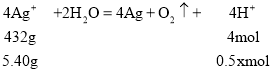
�У�![]() =
=![]() ����ã�x=0.1������Һ��pH=1���������������������ڽ������˳����н���Ԫ�ش���HԪ�غ��ݴ��������ת�Ƶ��������֪��������������Ԫ����Ҫ�ĵ��ӵ��ڻ�С���ҳ���ת�Ƶ�������B������5.40gʱת�Ƶ�����0.05mol��A������þ��þԪ�ش���HԪ��ǰ�����������ϲ������������ʣ��ʴ���B���������ͭ��Һʱ������������1.60gͭ��Ҫת�Ƶ���0.05mol������ȷ��C���Ȼ�������Ԫ�ش�����Ԫ��ǰ�����������ϲ������������ʣ��ʴ���D���������������Һ�൱�ڵ��ˮ�����������������ʣ��ʴ���ѡB���ʴ�Ϊ��1��B��
����ã�x=0.1������Һ��pH=1���������������������ڽ������˳����н���Ԫ�ش���HԪ�غ��ݴ��������ת�Ƶ��������֪��������������Ԫ����Ҫ�ĵ��ӵ��ڻ�С���ҳ���ת�Ƶ�������B������5.40gʱת�Ƶ�����0.05mol��A������þ��þԪ�ش���HԪ��ǰ�����������ϲ������������ʣ��ʴ���B���������ͭ��Һʱ������������1.60gͭ��Ҫת�Ƶ���0.05mol������ȷ��C���Ȼ�������Ԫ�ش�����Ԫ��ǰ�����������ϲ������������ʣ��ʴ���D���������������Һ�൱�ڵ��ˮ�����������������ʣ��ʴ���ѡB���ʴ�Ϊ��1��B��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�صĵ��ʼ��仯����(������Һ)��ת����ϵ����֪�ڳ��³�ѹ�£�A�ǹ��壬B��C��D��E�Ƿǽ��������Ҷ������壬C�ʻ���ɫ��������F�ǵ���ɫ���壬������G����ɫ��ӦΪ��ɫ����������Jͨ��״���³���̬��D��E��Ӧ����һ�ִ̼�����ζ�����塣
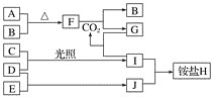
��ش��������⣺
(1)E��J�Ļ�ѧʽ�ֱ���________��________��
(2)д��F��CO2��Ӧ�Ļ�ѧ����ʽ���õ����ŷ���ʾ����ת�Ƶ������_________��
(3)����������Cͨ��ʢ�е��۵⻯����Һ���Թ��У���Һ����ɫ���÷�Ӧ�����ӷ���ʽΪ_________��
(4)�����3.36 L����B��A��ȫ��Ӧ��ת�Ƶ��ӵ���ĿΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Na2S2O5)�dz��õ�ʳƷ��������֮һ��ij�о�С���������ʵ�飺ʵ��һ�����������Ƶ���ȡ������ͼװ��(ʵ��ǰ�ѳ���װ���ڵĿ���)��ȡNa2S2O5��װ�â�����Na2S2O5���������������ķ�ӦΪNa2SO3��SO2=Na2S2O5��
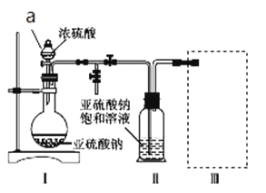
��1�����Լ�ǰҪ���еIJ�����__��װ�â��в�������Ļ�ѧ����ʽΪ__��
��2����װ�â��з������Ʒ�ɲ�ȡ�ķ��뷽����__��
��3��Ϊ������ʵ��װ�ã�������װ����ѡ��һ���������װ�÷���װ�â���ѡ�õ�װ��(�г���������ȥ)Ϊ__(�����)��
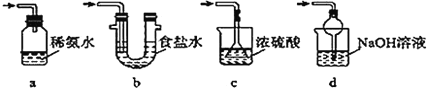
ʵ��������Ѿ��п��������������IJⶨ
��4�����ѾƳ���Na2S2O5�������������ⶨij���Ѿ��п��������IJ�����(������SO2����)�ķ�����ͼ��
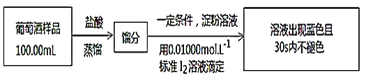
(��֪���ζ�ʱ��Ӧ�Ļ�ѧ����ʽΪSO2��I2��2H2O=H2SO4��2HI)
�ٰ���������ʵ�飬���ı�I2��Һ30.00mL���ô�ʵ������Ʒ�п��������IJ�����(������SO2����)Ϊ__g��L-1��
����ʵ��������в���HI��������������ⶨ���__(����ƫ��������ƫ��������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��2Fe2++Cl2=2Cl��+2Fe3+��2Br��+Cl2=Br2+2Cl����2Fe2++Br2=2Br��+2Fe3+����bL FeBr2��Һ��ͨ��amol Cl2ʱ��ʹ��Һ��50% ��Br������ΪBr2����ԭFeBr2�����ʵ���Ũ��Ϊ
A. a/bmolL��1 B. 2a/bmolL��1 C. 3a/bmolL��1 D. 5a/bmolL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������о������ʣ���H2 ���� ��Na2O2 ��CO2 ��H2SO4 ��Ba(OH)2���� �߰�ˮ ��ϡ���� ������Al2(SO4)3
��1�������ʵķ������д����Ŀհ״���
����� | �ܵ��� | �ǵ���� | ����� |
���ڸ�������� | ___ | ___ | ___ |
��2������ʮ������������������֮��ɷ������ӷ�Ӧ��H++OH-=H2O�������ӷ�Ӧ��Ӧ�Ļ�ѧ����ʽΪ___��
��3�������Ģߵμӵ������Һ�е����ӷ���ʽΪ___��34.2g������ˮ���250mL��Һ��SO42-�����ʵ���Ũ��Ϊ___��
��4������۳�ַ�Ӧ�Ļ�ѧ����ʽΪ��___����ת��NA���ӣ����ɱ������������Ϊ___��
��5����������Ӧ�Ļ�ѧ����ʽΪ��Al+4HNO3=Al(NO3)3+NO��+2H2O���÷�Ӧ����������___���ѧʽ������ԭ���������������ʵ���֮����___������5.4gAl������Ӧʱ��ת�Ƶ��ӵ����ʵ���Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪AΪ����ɫ���壬TΪ������ʹ����㷺�Ľ������ʣ�D�Ǿ��д��Եĺ�ɫ���壬C����ɫ��ζ�����壬H�ǰ�ɫ������
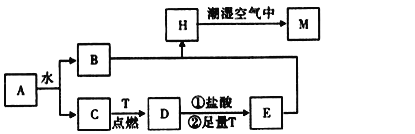
��1������A�Ļ�ѧʽΪ___��
��2��H�ڳ�ʪ�����б��M��ʵ��������__����ѧ����ʽΪ___��
��3��A��ˮ��Ӧ����B��C�����ӷ���ʽΪ__���г�A��һ����Ҫ��;__��
��4����Ӧ�ٵ����ӷ���ʽΪ__���ڼ�����T��Ŀ��___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�У���������������ԭ�����͵���
A.����������еİ�Һ�������ںϳɰ���Ӧ
B.��CO(g)+NO2(g)![]() CO2(g)+NO(g)ƽ����ϵ����ѹǿ��ʹ����ɫ����
CO2(g)+NO(g)ƽ����ϵ����ѹǿ��ʹ����ɫ����
C.�����£���1mLpH��3�Ĵ�����Һ��ˮϡ�͵�100mL�������pH��5
D.ʵ�����г����ű���ʳ��ˮ�ķ����ռ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NA���������ӵ�������ֵ������˵������ȷ����
A.20g NaOH����1Lˮ�������0.5mol/LNaOH��Һ
B.100mL 0.1mol/L������Һ�к��е���ԭ����ԼΪ0.04NA
C.5 mL 0.3 mol/L Na2SO4��Һ��5 mL 0.3 mol/L NaNO3��ҺNa�� ���ʵ���Ũ�����
D.a g C2H4��C3H6�Ļ��������̼ԭ����Ϊ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǿ��淴ӦA��2B![]() 2C��3D�Ļ�ѧ��Ӧ�����뻯ѧƽ������������ı䣨�Ƚ��º��ѹ�����仯��������ɴ˿��ƶ�
2C��3D�Ļ�ѧ��Ӧ�����뻯ѧƽ������������ı䣨�Ƚ��º��ѹ�����仯��������ɴ˿��ƶ�
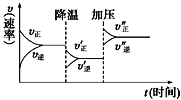
A.����Ӧ�Ƿ��ȷ�ӦB.D����������
C.�淴Ӧ�Ƿ��ȷ�ӦD.A��B��C��D��Ϊ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com