
【题目】实验室取用KClO3和MnO2的混合物(共33.2g),加热至恒重,将反应后的固体加30g水充分溶解,剩余固体13.1g(t℃),再加10g水充分溶解,仍剩余固体9.6g(t℃)。
(1)若剩余的9.6g固体全是MnO2,且溶液的体积为VL,则此时c(K+)为______。(结果用含V的最简化代数式表示)
(2)若剩余的9.6g固体是MnO2和KCl的混合物,则混合物中KClO3的质量为______。
【答案】![]() mol/L 24.5g
mol/L 24.5g
【解析】
(1)若剩余的9.6g固体全是MnO2,m(KClO3)=33.2g-9.6g,结合n=![]() 、c=
、c=![]() 计算;
计算;
(2)若剩余的9.6g固体是MnO2和KCl的混合物,反应前后质量减少的质量为氧气的质量,根据氯酸钾和氧气之间的关系式计算氯酸钾的质量。
(1)若剩余的9.6g固体全是MnO2,m(KClO3)=33.2g-9.6g=23.6g,n(K+)=n(KClO3)=![]() =
=![]() mol,则c(K+)=
mol,则c(K+)=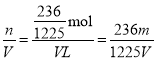 mol/L;
mol/L;
(2)若剩余的9.6g固体是MnO2和KCl的混合物,则10g水溶解氯化钾得到的溶液是饱和溶液,10g水溶解KCl的质量=13.1g-9.6g=3.5g,40g水溶解氯化钾的质量=3.5g×4=14g,反应前后质量减少的质量为氧气的质量,说明生成氧气的质量为:33.2g-14g-9.6g=9.6g,根据氧原子守恒得:n(KClO3)=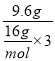 =0.2mol,则原混合物中KClO3的质量为122.5g/mol×0.2mol=24.5g。
=0.2mol,则原混合物中KClO3的质量为122.5g/mol×0.2mol=24.5g。


科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。回答有关中和反应的问题:
(1)用0.1molNaOH配成稀溶液与足量稀硝酸反应,放出_____热量。
(2)如图装置中缺少的一种玻璃仪器是___,碎泡沫塑料的作用____。
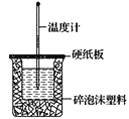
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ·mol-1,其原因可能是____。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热ΔH会___(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法不正确的是
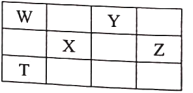
A.原子半径:r(X)>r(Z)>r(W)>r(Y)
B.单质Z2、Y3和Z与Y形成的化合物ZY2均可用于自来水消毒
C.X元素可形成两种或以上的单质,且在一定条件下可以相互转化
D.T元素的单质具有半导体的特性,其最高价氧化物对应水化物是一种强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 MnO2是一种重要的无机功能材料,工业上提纯粗MnO2(含有较多的MnO和MnCO3)实验工艺流程如下图,则下列说法不正确的是
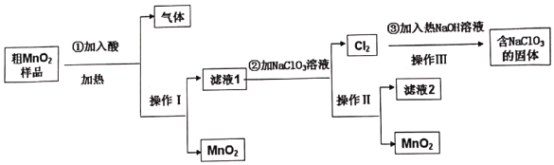
A.若①加入的是稀H2SO4,实际生产中可由滤液2进一步制得副产品Na2SO410H2O
B.操作Ⅲ是减压蒸发,理论上得到的固体NaCl和NaClO3物质的量之比为5:1
C.①加酸的目的是溶解MnO和MnCO3,实际生产可以用浓盐酸进行溶解
D.②反应的离子方程式:5Mn2++2ClO3-+4H2O=5MnO2↓+Cl2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A在标准状况下的密度为1.25g/L,绿色植物通过光合作用将B和水转化为G和F,其中F是重要的营养物质。E是具有果香味的油状液体,且存在如下转化关系。
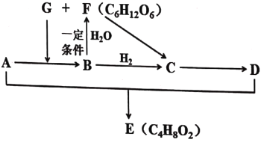
(1)D中官能团的名称是______。A与D的反应类型为______。
(2)写出B与H2在一定条件下生成C的反应方程式______。
(3)下列说法不正确的是______。
A.E和F在酸性下均可水解得到C
B.由A可直接反应生成C,也可直接反应生成D,两个反应类型相同
C.用新制的Cu(OH)2悬浊液能鉴别C、D、E、F四种物质
D.等质量的F、D、E物质完全燃烧,三者消耗![]() 的量相同
的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
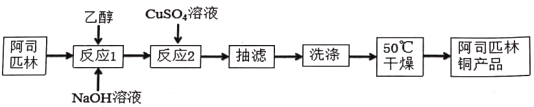
【题目】阿司匹林铜具有很强的抗炎作用。它是一种亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂中。易受热分解成浅绿色混合物。在强酸条件下能解离出铜离子。合成阿司匹林铜,其实验流程如下:
已知反应方程式如下:
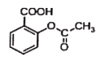 +NaOH→
+NaOH→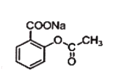 +H2O
+H2O
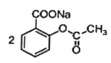 +CuSO4→
+CuSO4→ +Na2SO4
+Na2SO4
(1)下列有关说法正确的是_____。
A.反应1中加乙醇作溶剂,目的是增大接触面积,加快反应速率
B.用倾析法将反应2中的液体和沉淀同时转移到布氏漏斗中进行抽滤
C.洗涤操作中,可先用水洗2-3次,再用酒精洗涤2-3次
D.干燥后发现固体呈浅绿色,可能是烘干温度过高造成的结果
(2)反应1中的反应温度要求控制在室温的理由是______。
(3)阿司匹林铜中铜含量的测定,可用碘量法测定:
步骤一:准确称取0.800g样品,置于250mL锥形瓶中,加4mL3.00mol/L,再加20mL水,加热煮沸,样品完全分解后,摇匀,冷却到室温。
步骤二:往溶液中加入1.200gKI摇匀,用0.100mol/LNa2S2O3标准溶液滴定至溶液变浅黄色时,加入10mL 10% KSCN试剂,并加几滴淀粉溶液,继续用0.100mol/LNa2S2O3标准溶液滴定至终点,共消耗溶液体积为23.00mL。
已知:CuI难溶于水,能吸附碘;I2+2S2O32-=S4O62-+2I-。
CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①实验中加入10mL 10%KSCN试剂的目的是______。
②上述测定实验中,继续滴加Na2S2O3标准溶液至终点的具体实验操作______。
③该样品中的铜含量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
A. 混合气体的压强 B. 气体的总物质的量
C. 混合气体的密度 D. 单位时间内生成n molC的同时消耗2n molB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.9g超重水(3H216O)含中子数为6NA
B.标准状况下,22.4L CCl4含有的分子数目为NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D.一定条件下,将1mol N2和3mol H2混合,充分反应后转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如下实验装置验证用蘸有浓氨水的棉签检验运送氯气的管道是否有氯气泄漏(已知:8NH3+3Cl2=N2+6NH4Cl)。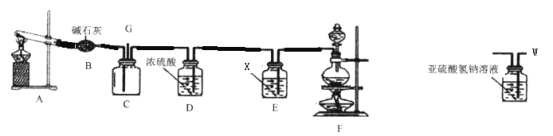
回答下列问题:
(1)写出A装置中反应的化学方程式________;
(2)试剂X为__________;
(3)写出装置F制取氯气的离子方程式为________;
(4)装置B的作用是_______,装置C中的现象是__________;
(5)G端连接上图装置W的作用是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com