
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。回答有关中和反应的问题:
(1)用0.1molNaOH配成稀溶液与足量稀硝酸反应,放出_____热量。
(2)如图装置中缺少的一种玻璃仪器是___,碎泡沫塑料的作用____。
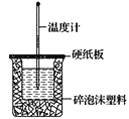
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ·mol-1,其原因可能是____。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热ΔH会___(填“偏大”、“偏小”或“无影响”)。
【答案】5.73kJ 环形玻璃搅拌棒 保温、隔热的作用 实验过程中难免有热量散失 偏大
【解析】
(1)根据H+(aq)+OH-(aq)═H2O(l) △H=-57.3kJmol-1可知生成1molH2O放出热量为57.3kJ,然后根据水的物质的量与热量成正比求出热量;
(2)中和热测定的实验中需要量筒、温度计、环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作;
(3)若保温效果不好,有热量散失,求得的中和热ΔH将会偏大;
(4)根据弱电解质电离吸热分析。
(1)由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJmol-1可知生成1molH2O放出热量为57.3kJ,而0.1mol NaOH配成稀溶液与足量稀硝酸反应可得0.1molH2O,所以放出的热量为57.3kJ×0.1=5.73kJ;
(2)中和热测定的实验中需要量筒、温度计、环形玻璃搅拌棒,还缺少环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热作用;
(3)若保温效果不好,有热量散失,求得的中和热ΔH将会偏大,△H大于-57.3kJmol-1;
(4)NH3H2O为弱碱,电离过程为吸热过程,用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热ΔH的数值偏大,则中和热ΔH会偏大。


科目:高中化学 来源: 题型:
【题目】已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是 ( )
A. 海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B. 海水![]() MgCl2溶液
MgCl2溶液![]() MgCl2熔融
MgCl2熔融![]() Mg
Mg
C. 海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D. 海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() MgCl2熔融
MgCl2熔融![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(s)![]() 2B(g)+C(g)+D(g)已达到平衡状态的是( )
2B(g)+C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强②混合气体的密度③A的物质的量浓度④混合气体总物质的量 ⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值 ⑦混合气体总质量 ⑧混合气体总体积
A.③④⑤⑥⑧B.①②⑥⑦C.①②④⑦D.①③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是H2S和SO2)的转化具有重要意义。
(1)H2S资源化利用途径之一是回收能量并得到单质硫,如图为质子膜H2S燃料电池的示意图。
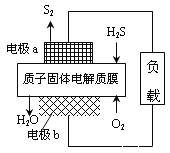
①电极a为电池的_______极,电极b上发生的电极反应为:______________________。
②每17gH2S参与反应,有_____molH+经质子膜进入_____极区。
(2)低浓度SO2废气的处理是工业难题,目前常用的方法如下:
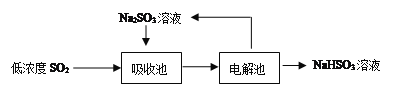
①Na2SO3溶液吸收SO2的化学方程式是____________________________________。
②如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是(____)
A.Na2SO3B.Na2S C.Ba(NO3)2 D.酸性KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组拟合成染料X和医药中间体Y。
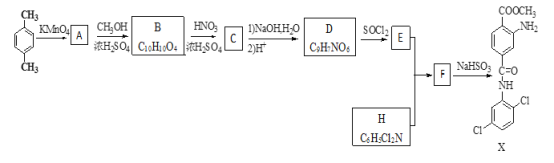
已知:①![]() ②
②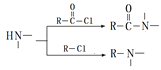 ③
③![]() ④
④![]() 。
。
(1)下列说法正确的是_________。
A.化合物A能与能与NaHCO3反应产生气体 B.X的分子式是C15H14Cl2O3N2
C.化合物C能发生取代、还原、加成反应 D.A→B,B→C的反应类型均为取代反应
(2)化合物D的结构简式是_________。
(3)写出E+H→F 的化学反应方程式__________________。
(4)写出化合物B(C10H10O4)同时符合下列条件的两种同分异构体的结构简式______________。
①与NaHCO3溶液反应,0.1mol该同分异构体能产生4.48L(标准状况下)CO2气体;②苯环上的一氯代物只有两种且苯环上的取代基不超过三个;③核磁共振氢谱有五种不同化学环境的氢,且峰面积比为1:2:2:2:3。
(5)设计以乙烯为原料合成制备Y(![]() )的合成路线________________(用流程图表示,无机试剂任选)。
)的合成路线________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54mol电子。
(1)该融雪剂的化学式是____,该物质中化学键类型是______,电子式是______。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为_________,电子式为_______,化学键类型为_________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____,其化学键类型为___;加热时生成_____,其化学键类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)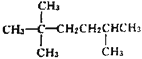 ,请用系统命名法对该物质进行命名:___。若该烃为一单烯烃的加成产物,则单烯烃可能有___种结构。
,请用系统命名法对该物质进行命名:___。若该烃为一单烯烃的加成产物,则单烯烃可能有___种结构。
(2)某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%,A的分子式为___。
(3)若25℃时CH3COOH的电离平衡常数Ka=1.8×10-5mol·L-1,向aLCH3COOH溶液中加入bmol CH3COONa,混合液恢复至25℃时呈中性,则原 CH3COOH溶液的物质的量浓度为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室取用KClO3和MnO2的混合物(共33.2g),加热至恒重,将反应后的固体加30g水充分溶解,剩余固体13.1g(t℃),再加10g水充分溶解,仍剩余固体9.6g(t℃)。
(1)若剩余的9.6g固体全是MnO2,且溶液的体积为VL,则此时c(K+)为______。(结果用含V的最简化代数式表示)
(2)若剩余的9.6g固体是MnO2和KCl的混合物,则混合物中KClO3的质量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com