
【题目】在3L的密闭容器中充入2mol A气体和2mol B气体,在一定条件下发生反应:2A(g)+B(g)2C(g),达平衡时,在相同温度下测得容器内混合气体的压强是反应前的0.8倍,则A的转化率为 .
【答案】80%
【解析】解:同温同体积时,气体的压强之比等于物质的量之比,故平衡时气体的物质的量为0.8×(2mol+2mol)=3.2mol,令参加反应的A的物质的量为xmol,则:
2A(g)+B(g)2C(g) | 气体体积减少△V |
2 | 1 |
xmol | 4mol﹣3.2mol=0.8mol |
故xmol:0.8mol=2:1,解得x=1.6
故A的转化率为 ![]() ×100%=80%
×100%=80%
所以答案是:80%.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】浓硫酸溶于水使溶液的温度升高,是由于( )
A.浓硫酸溶于水,只发生扩散过程
B.浓硫酸溶于水,只发生水合过程
C.浓硫酸溶于水,扩散过程吸收的热量大于水合过程放出的热量
D.浓硫酸溶于水,扩散过程吸收的热量小于水合过程放出的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,硫化铜矿的湿法冶炼已经取得很大的进展.现有一种催化氧化酸浸硫化铜矿的湿法冶炼法,其工艺流程如1图所示: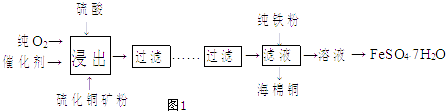
温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图2﹣图5所示)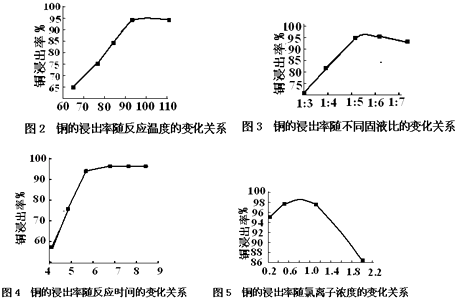
(1)根据实验以及工业生产的实际要求,从图2﹣图5中得出的最佳工艺条件为(从下表中选出序号) .
反应温度/℃ | 固液比 | c(Cl﹣)/molL﹣1 | 反应时间/h | |
A | 95 | 1:5.5 | 0.8 | 6 |
B | 100 | 1:5.5 | 0.7 | 7 |
C | 110 | 1:6 | 0.9 | 8 |
(2)上述流程从溶液中得到纯净的FeSO47H2O晶体的操作是蒸发浓缩、冷却结晶、过滤、、用乙醇淋洗、干燥.用乙醇淋洗的目的是: .
(3)副产品FeSO47H2O样品的纯度可用滴定法进行测定,实验步骤如下:步骤1:称取5.800g绿矾产品,经溶解、定容等步骤准确配制250mL溶液.
步骤2:从上述容量瓶中量取25.00mL待测溶液于锥形瓶中,
步骤3:用硫酸酸化的0.0100mol/L KMnO4溶液滴定至终点,记录消耗KMnO4溶液体积
步骤4:重复步骤2、步骤3一至两次.
①步骤1中用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管和 , 步骤2量取溶液所用仪器是 .
②写出步骤3反应的离子方程式:
③数据处理:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00mL | 0.02 | 40.01 |
2 | 25.00mL | 0.70 | 40.71 |
3 | 25.00mL | 0.20 | 39.20 |
计算上述样品中FeSO47H2O的质量分数为 .
④不考虑操作误差,用上述方法测定的样品中FeSO47H2O的质量分数(填偏低、偏高或无影响).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.水的电离方程式:H2O=H++OH﹣
B.pH=7的溶液一定是中性溶液
C.升高温度,水的电离程度增大
D.将稀醋酸加水稀释时,c(H+)减小,c(OH﹣)也减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果Na+、Fe3+、NO3-和M四种离子以物质的量之比2∶1∶4∶1共存于同一溶液中,那么M可能是
A. Mg2+ B. OH- C. SO42- D. Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com