
| A、28L | B、11.2L |
| C、22.4L | D、5.6L |
科目:高中化学 来源: 题型:
| A、澄清石灰水中通入过量二氧化碳:OH-+CO2═HCO3- |
| B、铜片跟三氯化铁溶液反应:Fe3++Cu═Cu2++Fe2+ |
| C、漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| D、Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝与稀盐酸反应 Al+2H+=Al3++H2↑ |
| B、三氯化铁溶液与氢氧化钠溶液反应 FeCl3+3OH-=Fe(OH)3↓+3Cl- |
| C、用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O |
| D、二氧化碳与石灰水反应 CO2+2OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下甲烷和氧气的密度之比为2:1 |
| B、1 g甲烷和1 g氧气的原子数之比为5:1 |
| C、等物质的量的甲烷和氧气的质量之比为2:1 |
| D、在标准状况下等质量的甲烷和氧气的体积之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁恰好将Fe3+全部还原 |
| B、往反应后溶液中滴入KSCN溶液,不显红色 |
| C、溶液变为浅绿色 |
| D、Fe2+和Fe3+物质的量之比为6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
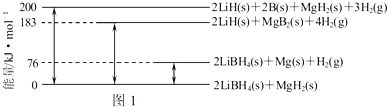
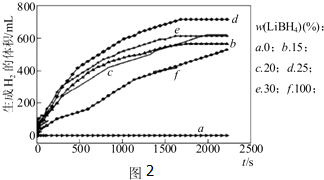
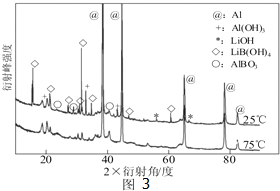
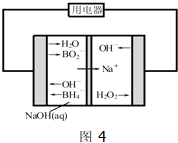
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.| n/mol t/min |
NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com