
| A、铁恰好将Fe3+全部还原 |
| B、往反应后溶液中滴入KSCN溶液,不显红色 |
| C、溶液变为浅绿色 |
| D、Fe2+和Fe3+物质的量之比为6:1 |
| m |
| M |
| 1.12g |
| 56g/mol |
| m |
| M |
| 1.12g |
| 56g/mol |


科目:高中化学 来源: 题型:
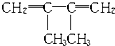 和b mol CH2=CH-CN按一定比例加聚成高分子化合物A.一定量的A完全燃烧生成CO2(g)、H2O(g)和N2(g),其中CO2的体积分数为57.14%,则形成A的两有机物的物质的量比为( )
和b mol CH2=CH-CN按一定比例加聚成高分子化合物A.一定量的A完全燃烧生成CO2(g)、H2O(g)和N2(g),其中CO2的体积分数为57.14%,则形成A的两有机物的物质的量比为( )| A、1:1 | B、1:2 |
| C、2:3 | D、3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴乙烷与氢氧化钠溶液共煮后,加入硝酸银溶液检验Br- |
| B、用电石与饱和食盐水制乙炔 |
| C、用苯、浓硝酸和18.4mol/L的硫酸制硝基苯 |
| D、用稀硝酸洗涤做过银镜反应的试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液和胶体的本质区别在于是否有丁达尔效应 |
| B、实验测得Fe(OH)3胶体能导电,但Fe(OH)3胶体不属于电解质 |
| C、“雨后彩虹”“海市蜃楼”既是一种自然光学现象,又和胶体知识有关 |
| D、向沸水中滴加几滴饱和FeCl3溶液,再加热到液体呈红褐色,可得到 Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com