
| 1 |
| x |
| 42 |
| 28 |
| 2 |
| 3 |
| 1 |
| 3 |
| 4 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| [CO2]?[H2] |
| [CO]?[H2O] |
| ||||||||
|
| [CO2]?[H2] |
| [CO]?[H2O] |
(
| ||||
(
|
| 1.2mol |
| 3mol |


科目:高中化学 来源: 题型:
| A、苯 (苯酚)--加入适量浓溴水,过滤 |
| B、NO (NO2)--通过水洗、干燥后,用向下排空气法收集 |
| C、乙烷 (乙烯)--让气体通过盛有酸性高锰酸钾溶液的洗气瓶 |
| D、乙醇 (乙酸)--加足量CaO固体,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁恰好将Fe3+全部还原 |
| B、往反应后溶液中滴入KSCN溶液,不显红色 |
| C、溶液变为浅绿色 |
| D、Fe2+和Fe3+物质的量之比为6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
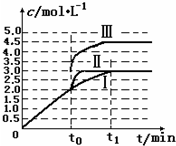 碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.| n/mol t/min |
NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com