
【题目】(1)把下列现象中硫酸所表现出来的性质填写在空白处.
①把锌粒放入稀硫酸中时,有气体放出.
②盛有浓硫酸的烧杯敞口放置一段时间后,质量增加.
③用玻璃棒蘸浓硫酸滴在纸上时,纸变黑.
④把木炭放入热的浓硫酸中时,有气体放出.
⑤在常温下可以用铁、铝制容器盛装冷的浓硫酸.
(2)实验室制取氨气的化学方程式: .
(3)铜与稀硝酸反应的离子方程式: .
(4)铜与浓硝酸反应的化学方程式:
(5)氢氧化钠溶液和铵盐溶液共热发生的离子方程式: .
【答案】(1)①酸性;
②吸水性;
③脱水性;
④强氧化性;
⑤强氧化性;
(2)2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)3Cu+8H++2NO3﹣(稀)═3Cu2++2NO↑+4H2O;
(4)Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;
(5)NH4++OH﹣![]() NH3↑+H2O.
NH3↑+H2O.
【解析】
试题分析:(1)硫酸具有强酸性,可用于制备氢气;具有吸水性,可用作干燥剂;具有吸水性,可使碳氢氧组成的有机物碳化,具有强氧化性,可使铝、铁钝化,在加热条件下与碳发生氧化还原反应,
①锌粒和稀硫酸发生反应生成氢气;
②浓硫酸具有吸水性,能吸收水分而作干燥剂;
③浓硫酸能将有机物中的H、O元素以水分子形式脱去;
④把木炭放入热的浓硫酸中时生成二氧化碳、二氧化硫和水;
⑤常温下,浓硫酸和铁、铝发生钝化现象;
(2)根据盐碱的复分解反应确定方程式;
(3)铜和稀硝酸反应生成硝酸铜、一氧化氮和水;
(4)铜和浓硝酸反应生成硝酸铜,二氧化氮和水;依据化学方程式书写方法写出;
(5)反应生成氯化钠、氨气、水.
解:(1)①稀硫酸和锌反应生成了氢气,表现了硫酸的酸性,故答案为:酸性;
②浓硫酸具有吸水性,能吸收空气中的水蒸气,所以盛有浓硫酸的烧杯敞口放置一段时间后因为吸收空气中的水蒸气而导致质量增加,故答案为:吸水性;
③浓硫酸将纸张中的H、O元素以2:1水分子的形式脱去,体现脱水性,故答案为:脱水性;
④把木炭放入热的浓硫酸中时生成二氧化碳、二氧化硫和水,体现的是浓硫酸的强氧化性,故答案为:强氧化性;
⑤工业上用铁槽车或铝槽车运输浓硫酸,利用了浓硫酸的强氧化性,与铝、铁在常温下发生钝化反应,故答案为:强氧化性;
(2)实验室制取氨气的化学方程式:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(3)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3﹣(稀)═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3﹣(稀)═3Cu2++2NO↑+4H2O;
(4)铜与浓硝酸反应生成硝酸铜,二氧化氮和水,反应的化学方程式为Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,
故答案为:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O;
(5)反应生成氯化钠、氨气、水,离子反应为NH4++OH﹣![]() NH3↑+H2O,故答案为:NH4++OH﹣
NH3↑+H2O,故答案为:NH4++OH﹣![]() NH3↑+H2O.
NH3↑+H2O.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 单晶硅是石英的主要成分
B. 钠钾合金可用于快中子反应堆的热交换剂
C. 小苏打可用于焙制糕点
D. 水玻璃暴露在空气中会发生变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下单质碘为固体,单质氯为气体。尽管两者存在的状态不同,但两者( )
A. 均含离子键 B. 都含离子键和共价键
C. 均含共价键 D. 均可与H2形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等质量的甲、乙两种气体分别充入两个密闭容器中,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
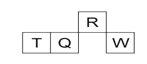
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是
A. 最简单气态氢化物的热稳定性:R > Q
B. 含 T 的盐溶液一定显酸性
C. 原子半径:T > Q > R
D. 最高价氧化物对应水化物的酸性:Q < W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O![]() A1O2一 + 4NH4++ 2H2O
A1O2一 + 4NH4++ 2H2O
B.NaHCO3溶液和足量Ca(OH)2溶液反应:Ca2++2OH-+2HCO3一=CaCO3↓+ CO32-+ 2H2O
C.酸性条件下,KIO3溶液与KI溶液反应:IO3-+5I-+3H2O![]() 3I2+6OH-
3I2+6OH-
D.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 增大反应体系的压强,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对应关系错误的是( )
A | NaCl===Na++Cl-; NH3·H2O | 均属于电离方程式 |
B | Ba2++SO42- ===BaSO4↓; HCO3-+OH-===CO32- +H2O | 均可表示一类反应 |
C | SO2使酸性高锰酸钾溶液褪色;SO2使碱性酚酞溶液褪色 | 均利用SO2的同一性质 |
D | Cl2+2NaOH===NaCl+NaClO+H2O; 3S+6NaOH===2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com