
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂已略去)

已知: ①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
②![]()
③![]()
请回答下列问题:
(1)B的化学名称为______________。A中官能团的电子式为________________。
(2)C中共面的原子最多有________个。I的结构简式为_____________________。
(3)F→G的化学方程式为________________________________________________。
(4)M不可能发生的反应为_______________(填选项字母)
A.加成反应 B.氧化反应 C.取代反应 D.消去反应
(5)同时满足下列条件的E的同分异构体有_________种。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有—个—NH2
(6)参照上述合成路线,以 ![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:_______________________________________________。
的合成路线:_______________________________________________。
【答案】 丙二醛 ![]() 9
9 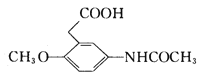
![]()
![]() D 10
D 10 ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】A的密度是相同条件下H2密度的38倍,则A的相对分子质量为76,其分子的核磁共振氢谱中有3组峰,根据流程图,A属于醇类,且含有3个碳原子,则B为丙二醛,A为丙二醇。根据信息②,F为![]() ;结合H和M的结构和信息③,I为
;结合H和M的结构和信息③,I为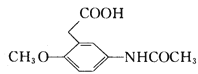 。
。
(1)B为丙二醛。A为丙二醇,其中官能团为羟基,电子式为![]() ,故答案为:丙二醛;
,故答案为:丙二醛;![]() ;
;
(2)C为丙二酸,羧基中的羰基是平面结构,C中共面的原子最多有9个。I为 ,故答案为:9;
,故答案为:9; ;
;
(3)F为![]() ,F→G的化学方程式为
,F→G的化学方程式为![]()
![]() ,故答案为:
,故答案为: ![]()
![]() ;
;
(4)M中含有羧基和羟基,可以发生取代反应,羟基能够被氧化,含有肽键,能够发生水解反应,含有苯环,能够发生与氢气的加成反应,不能发生消去反应,故选D;
(5)E为![]()
(6)以 ![]() 为原料制备
为原料制备![]() ,可以首先制得
,可以首先制得 ![]() ,再由
,再由![]() 发生缩聚反应即可。由
发生缩聚反应即可。由![]() 制
制![]() ,需要将溴原子水解为羟基,再氧化就可以得到羧基,将硝基还原就可以得到氨基,因此合成路线为:
,需要将溴原子水解为羟基,再氧化就可以得到羧基,将硝基还原就可以得到氨基,因此合成路线为:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 。
。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】下列有关金属及其化合物的说法正确的是
A.室温时,金属钠保存不当会变成Na2O2
B.Mg和Fe在一定条件下与水反应都生成氢气和对应的碱
C.氧化铁俗称铁红常作红色油漆和涂料
D.由于铝在空气中不会锈蚀,故铝制品的使用寿命都很长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学完成如下实验。
(1)实验记录(请补全表格中空格)
实验步骤 | 实验现象 | 离子方程式 |
| ①溶液分层 ②下层呈橙色。 | _____________ |
| ①溶液分层 ②__________ | Br2+2I-=I2+2Br- |
(2)该实验的目的是______________________。
(3)氯、溴、碘单质氧化性逐渐减弱的原因:同主族元素,最外层电子数相同,从上到下, _________,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃,H2A的电离常数Kl=6.0×10-2,K2=6.0×10-5。此温度下,将1 mL浓度为0.1mol/L, 的H2A溶液加水稀释到1000mL。下列说法正确的是
A. 上述稀释过程中,H2A分子及所有离子浓度均减小
B. 上稀释过程中,![]() 的变化趋势保持增大
的变化趋势保持增大
C. 上述溶液稀释前后均存在:c(H+)=c(OH-)+2c(A2-)
D. 根据H2A的电离常数,可推知0.1mol/L NaHA溶液的pH值大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分被氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
下列说法正确的是

A. V=448 B. 样品中CuO的质量为4.0 g
C. 滤液A中的阳离子为Fe2+、Fe3+、H+ D. 样品中Fe元素的质量为2.14 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。回答下列问题:
(1)联氨分子的电子式为 ,其中氮的化合价为 。
(2)实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 。
(3)①2O2(g)+N2(g)==N2O4(l) △H1
②N2(g)+2H2(g)==N2H4(l) △H2
③O2(g)+2H2(g)==2H2O(g) △H3
④2N2H4(l)+N2O4(l)==3N2(g)+4H2O(g) △H4=-1048.9kJ-mol-1
上述反应热效应之间的关系式为△H4= ,联氨和N2O4可作为火箭推进剂的主要原因为 。
(4)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为 (已知:N2H4+H+![]() N2H5+的K=8.7xl07; Kw=1.0xl0-14)。联氨与硫酸形成的酸式盐的化学式为 。
N2H5+的K=8.7xl07; Kw=1.0xl0-14)。联氨与硫酸形成的酸式盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 。联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2 kg;与使用Na2S03处理水中溶解的O2相比,联氨的优点是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.1molNaCl固体溶于水,配成1L 溶液,溶液中NaCl的物质的量浓度是
A. 2 mol/L B. 0.2 mol/L C. 1 mol/L D. 0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束后,将剩余的固体滤出,发现固体能被磁铁吸引,则反应后溶液中大量存在的阳离子是
A.Fe2+ B.H+ C.Cu2+和Fe2+ D.Fe3+和Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com