

 O2��+ 2Cu + 2H2SO4��2�֣�
O2��+ 2Cu + 2H2SO4��2�֣� O2��+ 2Cu + 2H2SO4��
O2��+ 2Cu + 2H2SO4�� ��
�� ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ZrC��SiO2��2CO�����÷�Ӧ���������뻹ԭ����������Ϊ ��
ZrC��SiO2��2CO�����÷�Ӧ���������뻹ԭ����������Ϊ ��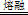 ��Na2ZrO3+��CO2+��H2O
��Na2ZrO3+��CO2+��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��1molAl��������NaOH��Һ��Ӧ��ʧȥ�ĵ�����Ϊ3NA(NA��ʾ�����ӵ�����) |
| B��ԭ��صĸ�������������Ӧ�����ص�����������ԭ��Ӧ |
| C��Cu�ܱ�FeCl3��Һ��ʴ�������ӷ���ʽΪ��Cu+Fe3+=Cu2++Fe2+ |
| D��Na+��Ba2+��NO3����SO32��������������Һ������������ԭ��Ӧ�����ܴ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 3HNCO��8HNCO+6NO2
3HNCO��8HNCO+6NO2 7N2+8CO+4H2O��
7N2+8CO+4H2O��| A��C3N3(OH)3��HNCOΪͬһ���� | B��1mol HNCO��NO2��Ӧʱת��3mol���� |
| C��HNCO��ǿ������ | D����Ӧ��CO2���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Na2O2ֻ�������� |
| B��FeSO4Ϊ��ԭ�� |
| C����Ԫ�ر���ԭ |
| D��2 mol FeSO4������Ӧʱ����Ӧ�й���8 mol����ת�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NaH��H�Ļ��ϼ�Ϊ��1�ۣ��������� |
| B���ڸ÷�Ӧ��H2O Ϊ��ԭ�� |
| C���ڸ÷�Ӧ��NaH Ϊ��ԭ�� |
D���÷�Ӧ�е���ת�Ƶķ������Ŀ���Ա�ʾΪ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��CuS���ܽ�ȴ���PbS���ܽ�� |
| B��ԭ��ͭ��������л�ԭ�ԣ���ͭ��û�л�ԭ�� |
| C��CuSO4��ZnS��Ӧ�����ӷ���ʽ��Cu2++S2��====CuS�� |
| D�����������漰�ķ�Ӧ������������ԭ��Ӧ���ֽⷴӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ������һ�������¿���Mn2+��������Ϊ
������һ�������¿���Mn2+��������Ϊ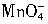 ������Ӧ��
������Ӧ�� ���ӱ�Ϊ
���ӱ�Ϊ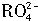 ���ӣ�
���ӣ�| A��1 | B��2 | C��3 | D��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2NaBr + Cl2 =" 2NaCl" + Br2 |
| B��KClO3 + 6HCl ="==" KCl + 3Cl2�� + 3H2O |
| C��2H2S + SO2 = 3S�� + 2H2O |
| D��AlCl3 + 3NaAlO2 + 6H2O = 4Al(OH)3�� + 3NaCl |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com