
| A、碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
| D、向NaHSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、XY3晶体一定是离子晶体 |
| B、若Y的原子序数为m,X的原子序数一定是m±4 |
| C、X和Y可属同一周期,也可属于两个不同周期 |
| D、X、Y一定不属于同一主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片与稀盐酸反应 |
| B、灼热的碳与CO2反应 |
| C、Ba(OH)2?8H2O与NH4Cl固体反应 |
| D、甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.02×1023就是阿伏加德罗常数 |
| B、0.012 kg 12C含有的碳原子数就是阿伏加德罗常数的值 |
| C、含有阿伏加德罗常数个粒子的物质的量是1 mol |
| D、1 mol NH3所含原子数约是2.408×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、③④ |
| C、②④⑥ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、NaH中氢离子结构示意图为: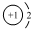 | ||||
B、NH4I的电子式: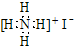 | ||||
C、质子数是82,中子数是122的铅原子:
| ||||
D、CO2的比例模型: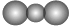 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
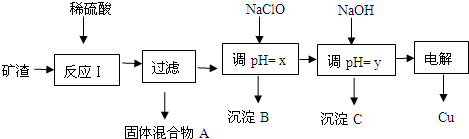
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com