
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |


科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
| B、Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| C、向氢氧化钡溶液中加硫酸溶液:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
| D、向NaHSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W(CaO)/% NaOH浓度/% 浸出率/% 碱用量c/(mol.L-1) | 0.1 | 1.3 | 1.3 | 2.7 |
| 30 | 30 | 40 | 40 | |
| 1.1 | 99.1 | 90.1 | 93.3 | 83.2 |
| 1.3 | 99.4 | 92.7 | 93.0 | 82.1 |
| 1.5 | 99.5 | 93.4 | 96.5 | 83.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
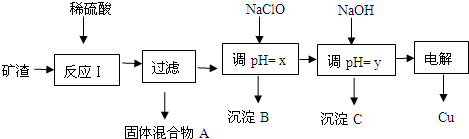
查看答案和解析>>
科目:高中化学 来源: 题型:
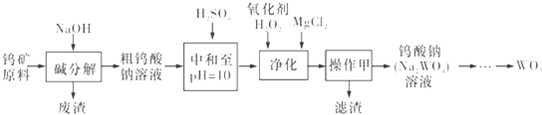
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Y>Z>W |
| B、XW2熔点为-107℃,沸点为12.5℃,说明固态XW2为分子晶体 |
| C、工业上电解熔融YW3可得单质Y |
| D、单质Y、Z、W均能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业酒精(含甲醇)兑水配自制白酒饮用 |
| B、用工业石蜡等给瓜子美容 |
| C、制作腊肉常加入亚硝酸盐作增色剂和防腐剂,宜长期食用 |
| D、在食用盐中加入碘酸钾(KIO3)以消除碘缺乏病 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com