
【题目】铬铁合金作为钢的添加料生产多种具有高强度、耐高温、耐腐蚀等优良性能的特种钢,这类特种钢中含有碳、硅、氧、氮、磷等元素。
(1)基态Cr原子的价电子排布式为___。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___。
(3)PO43-的空间构型为___,中心原子的杂化方式为___。
(4)无水CrCl3和氨分子作用能形成某种配合物,该配合物的组成相当于CrCl3·6NH3。已知:若加入AgNO3溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入NaOH溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构式__,1mol该配合物中含有σ键的数目为__。
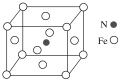
(5)铁和氮形成一种晶体,晶胞结构如图所示,则该晶体的化学式为___,若该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的体积是__cm3。
【答案】3d54s1 N>O>C 正四面体 sp3 [Cr(NH3)6]Cl3 24NA Fe4N ![]()
【解析】
根据题意可知,本题考查原子电子排布、元素电离能、粒子空间构型、中心原子杂化方式等,运用电子排布规则、元素电离能规律、VSEPR理论分析。
(1)基态Cr原子核外有24个电子,电子排布式为[Ar] 3d54s1,故价电子排布式为3d54s1;
故答案为:3d54s1;
(2)同周期主族元素从左到右第一电离能呈增大趋势,但由于N的2p能级上电子半充满,为较稳定结构,故其第一电离能大于O的第一电离能,故第一电离能:N>O>C;
故答案为:N>O>C;
(3)PO43-中P无孤电子对,形成的σ键数目为4个,空间构型为正四面体形,中心原子P的杂化方式为sp3杂化;
故答案为:正四面体形;sp3杂化;
(4) 加入AgNO3溶液,能将所有氯沉淀,说明Cl-为外界,加入NaOH溶液并加热,无刺激性气体产生,说明NH3在内界,故该配合物的结构式为[Cr(NH3)6]Cl3,该配合物中Cr与6个NH3之间的配位键均为σ键,NH3中N-H键为σ键,故1mol该配合物中含有σ键的数目为24NA;
故答案为:[Cr(NH3)6]Cl3;24NA;
(5)该晶胞中Fe位于顶点和面心,Fe原子个数为![]() ,N位于体心,个数为1,故该晶体的化学式为Fe4N。该晶胞质量为
,N位于体心,个数为1,故该晶体的化学式为Fe4N。该晶胞质量为![]() =
=![]() g,故该晶胞的体积为
g,故该晶胞的体积为![]() g
g ![]() g
g![]() cm3=
cm3=![]() cm3;
cm3;
故答案为:Fe4N;![]() 。
。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】有机物甲是芳香族化合物,取0.1mol有机物甲在足量氧气中完全燃烧后,生成0.7 mol CO2和5.4g H2O。甲的质谱如图所示,结构分析显示分子中存在 -OH和-COOH,苯环上有2种氢原子。
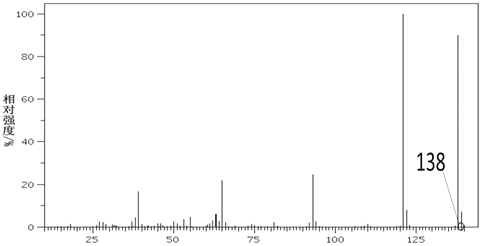
(1)甲的分子式为_______。
(2)甲的结构简式为____。
(3)甲可由相对分子量为92的芳香烃,经以下三步转化而得:
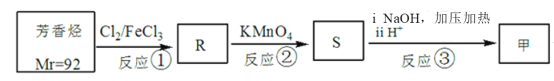
请写出S的结构简式____,以上流程中反应②和反应③能否互换___(填写“能”或者“不能”)。
(4)已知:![]() CH3CH2CHO+
CH3CH2CHO+ 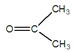 。某烃A的分子式为C6H10,经过上述转化生成
。某烃A的分子式为C6H10,经过上述转化生成![]() ,则烃A的结构可表示为:______。
,则烃A的结构可表示为:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由三种元素组成的化合物A,按如下流程进行实验。气体B为纯净物,溶液C焰色反应为砖红色,气体E能使湿润的红色石蕊试纸变蓝。
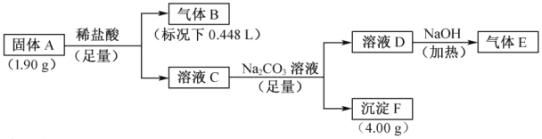
请回答:
(1)组成A的三种元素是________,A的化学式是________。
(2)固体A与足量稀盐酸反应的化学方程式是________。
(3)气体E与甲醛在一定条件可生成乌洛托品(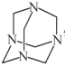 学名:六亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
学名:六亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的某恒容密闭容器中,建立下列化学平衡:C(s)+H2O(g)CO(g)+H2(g)。在一定条件下不能表示该可逆反应已达到化学平衡状态的是( )
A.体系压强不再发生变化
B.v正(CO)=v逆(H2O)
C.体系的气体的密度不再变化
D.1 mol HH 键断裂的同时形成 2 mol HO 键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
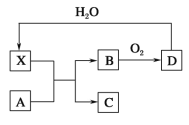
A.X使蔗糖变黑主要体现了X的吸水性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可观察到有白色沉淀产生
D.由B转化为D的反应是工业制备X过程中的重要反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是

A.CO、SO2、SO3均是酸性氧化物
B.工业上利用Cl2和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500g。
步骤Ⅱ 将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数___(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积___(填“偏大”、“偏小”或“无影响”)。
对滴定结果的分析最终都是由___的变化来分析C测变化。
③滴定时边滴边摇动锥形瓶,眼睛应观察___。
④滴定达到终点现象__ 。
(2)滴定结果如下表所示:
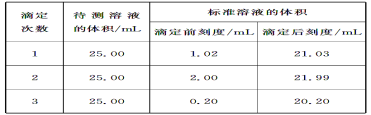
若NaOH标准溶液的浓度为0.1010mol/L,则该样品中氮的质量分数为___。(保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.2mol某有机物和0.5mol氧气在一密闭容器中燃烧得产物为CO2、CO、H2O(气)。产物通过浓硫酸时,浓硫酸的质量增加了7.2g;再通过灼热的氧化铜时,氧化铜的质量减少了3.2g;又通过碱石灰时,碱石灰的质量增加了17.6g。该有机物的化学式是( )
A.C2H4B.C2H6OC.C2H6O2D.C3H6O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示![]() 某些条件和部分产物已略去
某些条件和部分产物已略去![]() 。下列说法正确的是
。下列说法正确的是
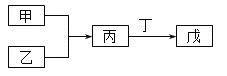
A.若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物
B.若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应
C.若丙、丁混合产生大量白烟,则乙可能具有漂白性
D.若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲![]() 丙
丙![]() 戊
戊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com