
【题目】LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( )
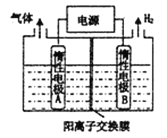
A. B极区电解液为LiOH溶液
B. 每产生2.24L氢气,就有0.2 mol阳离子通过交换膜进入阴极区
C. 电解过程中Li+向B电极迁移
D. 阳极电极反应式为2Cl--2e-=Cl2↑
【答案】B
【解析】
由图可知:B电极上有H2生成,则B为电解池的阴极,阴极电极反应式为2H2O+2e-=2OH-+H2↑,A为阳极,阳极反应式为2Cl--2e-=Cl2↑,左侧电解液为LiCl溶液,右侧电解液为LiOH溶液。
A项,根据分析可知B极区电解质溶液为LiOH溶液,故A项正确;
B项,标准状况下,2.24L氢气的物质的量为0.1mol,根据电极反应式可知转移0.2mol电子,阴极得电子,为了维持溶液电中性,有0.2mol带正电荷的阳离子(Li+)通过交换膜进入阴极区,由于没有指明是标准状况,故B项错误;
C项,电解池工作时,电解质溶液中的阳离子向阴极移动,即Li+向B电极迁移,故C项正确;
D项,A电极为阳极,电极上Cl-放电,电极反应式为2Cl--2e-=Cl2↑,故D项正确。
综上所述,本题正确答案为B。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,10 mL 4.0 mol/L H2O2发生分解:2H2O2![]() H2O+ O2
H2O+ O2![]() ,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
,不同时刻测定生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述正确的是(溶液体积变化忽略不计)
A. 6 min时反应速率υ(H2O2) = 3.33×10-2 mol/(L·mol)
B. 反应到6 min时,H2O2分解率为50%
C. 其他条件不变,若换用更高效的催化剂,达到平衡时将会得到更多氧气
D. 随时间增长得到的氧气更多,说明反应速率逐渐加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前海水液化可采用双极膜电液析法、同时获得副产品,其模拟工作原理如图所示。其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。M、N为离子交换膜。下列说法正确的是( )

A. X电极为电解池的阴极,该电极反应式为:2H+-2e-=H2↑
B. 电子流向:电源负极→X电极→Y电极→电源正极
C. 电路中每转移1mol电子,X、Y两极共得到标准状况下16.8L的气体
D. M为阳离子交换膜,A室获得副产品NaOH;若去掉B室双极膜,B室产物不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ―Q1 kJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 kJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3kJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为多少kJ
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2
C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有浓度都为0.1mol·L-1HA、HB的溶液各20mL,分别用0.1mol·L-1NaOH溶液滴定。溶液的pH与加入NaOH溶液体积V的关系如图所示。下列判断错误的是
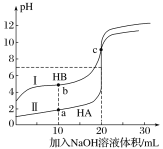
A. 滴定过程中,水电离的c(H+)·c(OH-)均不变
B. 相同条件下,HB的电离程度小于HA的电离程度
C. V=10mL时,c(HB)+c(B-)=2c(Na+)
D. V=20mL时,c(A-)>c(B-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的燃烧热的热化学方程式应为_________________。
(2)化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g) ΔH= +436 kJ·mol-1],形成化学键时ΔH<0[如2H(g)=H2(g) ΔH= - 436 kJ·mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH= -185 kJ·mol-1 ΔH298(H2)=+ 436 kJ·mol-1 ,ΔH298(Cl2)= +247 kJ·mol-1则ΔH298(HCl)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:NO+CO2![]() NO2+CO在密闭容器中进行,下列哪些条件加快该反应速率
NO2+CO在密闭容器中进行,下列哪些条件加快该反应速率
A. 增大体积使压强减小 B. 体积不变充人CO2使压强增大
C. 体积不变充人He气使压强增大 D. 压强不变充入N2使体积增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO- + H+
CH3COO- + H+
(1)某温度时,0.1 mol·L-1的醋酸溶液中的c(H+) 与0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(2)已知:25 ℃时,该电离平衡的平衡常数为1.75×10-5。
①求该温度时,a mol·L-1的醋酸溶液中c1(H+)=________________mol·L-1 (用含a的代数式表示)。[提示:此时电离度比较小,进行简化计算,平衡时c(CH3COOH)可用初始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的CH3COONH4(假设溶液体积不变),使溶液中c(CH3COO-)为b mol·L-1,则此时c2(H+)=____________________mol·L-1(用含a、b的代数式表示)。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对一定量气体体积的探究。
已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)___________________________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com