
 NaClO + H2↑ c(Na+)> c(ClO-)>c(OH-) >c( H+) (5)CuO(或CuCO3)
NaClO + H2↑ c(Na+)> c(ClO-)>c(OH-) >c( H+) (5)CuO(或CuCO3) NaClO + H2↑。疲劳寿命水解显碱性,则溶液中离子浓度大小关系是c(Na+)> c(ClO-)>c(OH-) >c( H+)。
NaClO + H2↑。疲劳寿命水解显碱性,则溶液中离子浓度大小关系是c(Na+)> c(ClO-)>c(OH-) >c( H+)。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源:不详 题型:单选题

 MnO2+Zn+2H2SO4
MnO2+Zn+2H2SO4| A.干电池是一种将化学能转变为电能的装置 |
| B.步骤③电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+ |
| C.步骤①每析出12.8g S沉淀,共转移0.8mol电子 |
| D.步骤③的反应也可以设计成原电池 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钢铁发生析氢腐蚀时,负极反应是Fe-3e-===Fe3+ |
| B.钢铁发生吸氧腐蚀时,正极反应是2H2O+O2+4e-===4OH- |
| C.钢管与电源正极连接时,钢管可被保护 |
| D.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 |
查看答案和解析>>
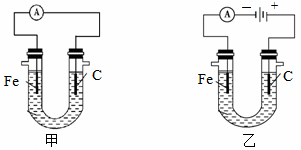
科目:高中化学 来源:不详 题型:单选题
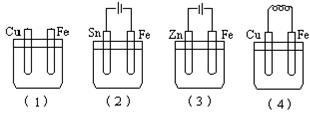
| A.(2)(4)(1)(3) | B.(3)(4)(1)(2) | C.(4)(3)(2)(1) | D.(1)(3)(2)(4) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
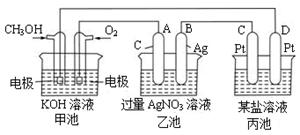
| A.MgSO4溶液 | B.CuSO4溶液 | C.NaCl溶液 | D.AgNO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com