
【题目】燃煤和汽车尾气是造成空气污染和雾霾天气的原因之一,化学在解决雾霾污染中发挥了重要作用。
(1)NOx主要来源于汽车尾气。
已知:N2(g) + 2O2(g)![]() 2NO2(g) ΔH=+67.5kJ/mol
2NO2(g) ΔH=+67.5kJ/mol
2CO(g) + O2(g)![]() 2CO2(g) ΔH=-566.0kJ/mol。
2CO2(g) ΔH=-566.0kJ/mol。
为了减轻大气污染,在汽车尾气排气管口采用催化剂将NO2和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式_____________。
(2)已知:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s),工业上可以利用I2O5消除CO的污染。不同温度下,向装有足量I2O5固体的4 L恒容密闭容器中通入2 mol CO,测得CO2的体积分数随时间变化的曲线如图。回答下列问题:
5CO2(g)+I2(s),工业上可以利用I2O5消除CO的污染。不同温度下,向装有足量I2O5固体的4 L恒容密闭容器中通入2 mol CO,测得CO2的体积分数随时间变化的曲线如图。回答下列问题:
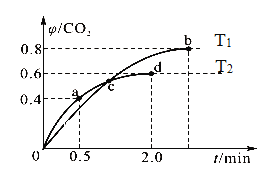
①从反应开始至a点时,v(CO)=___________。
②由图可知,该反应的ΔH________0(填“大于”或“小于”),b点时化学平衡常数K=___________。
③下列说法正确的是___________(填字母)。
A.d点时,增大体系压强,CO的转化率变大
B.容器内气体密度不变时,表明反应达到平衡状态
C.c点时体系中混合气体的压强在T2温度下更大
D.b点时,向平衡体系中再加入I2O5,平衡向正反应方向移动
(3)电解吸收是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。
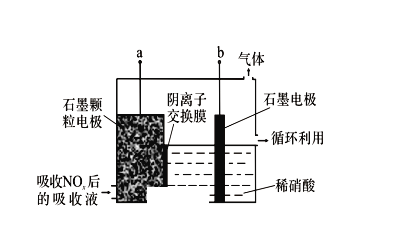
①图中b应连接电源的___________(填“正极”或“负极”)。
②阳极的电极反应式为___________。
【答案】 2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH=-1199.5 kJ/mol 0.4 mol/(L·min) 小于 1024 BC 负极 HNO2-2e-+H2O=NO3-+3H+
【解析】(1)NO2和CO在催化剂作用下发生氧化还原反应,生成无污染的氮气和二氧化碳,已知:①N2(g) + 2O2(g)![]() 2NO2(g) ΔH=+67.5kJ/mol ,②2CO(g) + O2(g)
2NO2(g) ΔH=+67.5kJ/mol ,②2CO(g) + O2(g)![]() 2CO2(g) ΔH=-566.0kJ/mol,由盖斯定律可知,②×2—①即得NO2和CO转化为氮气和二氧化碳的热化学方程式,2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH=-1199.5 kJ/mol。
2CO2(g) ΔH=-566.0kJ/mol,由盖斯定律可知,②×2—①即得NO2和CO转化为氮气和二氧化碳的热化学方程式,2NO2(g)+4CO(g)=N2(g)+4CO2(g) ΔH=-1199.5 kJ/mol。
(2)①设转化的CO物质的量浓度为x,根据三段式进行计算:
5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)
5CO2(g)+I2(s)
起始浓度(mol/L) 0.5 0
转化浓度(mol/L) x x
平衡浓度(mol/L) 0.5—x x
a点CO2的体积分数为0.4,则x/0.5=0.4,可得x=0.2 mol/L,则v(CO)=0.2mol/L÷0.5min = 0.4mol·L-1·min-1;
②图中d点先达到平衡,b点后达到平衡,说明T2大于T1,但CO2的体积分数反而小,说明升高温度,平衡逆向移动,则正反应是放热反应,即ΔH小于0;类似a点计算,可求出b点CO的平衡浓度为0.1 mol/L,CO2的 平衡浓度为0. 4mol/L,则b点时化学平衡常数Kb=c5(CO2)÷c5(CO)==45=1024。
③A.由于反应前后气体分子数不变即压强不变,在d点,其它条件不变时,增大体系压强,平衡不移动,CO的转化率不变,错误;B.容器内气体密度不变,说明气体的质量不变,则反应达到平衡状态,正确;C.因T2大于T1,且反应前后气体分子数不变,则c点时体系中混合气体的压强在T2温度下更大,正确;D.b点时,向平衡体系中加入I2O5是固体,不影响平衡移动,错误。故BC正确。
(3)①a电极上亚硝酸失电子生成硝酸,b电极上氢离子得电子生成氢气,所以a为阳极,b为阴极,则b与电源的负极相连;故答案为:负极;②阳极上亚硝酸失电子生成硝酸,其电极方程式为:HNO2-2e-+H2O=NO3-+3H+。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
A. 以Y浓度变化表示的反应速率为0.0005 mol/(L·s)
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2
C. 其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
D. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图: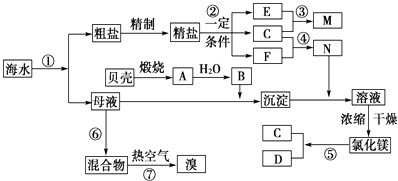
(1)Ⅰ.①写出N的化学式;②写出反应②的化学方程式 .
(2)Ⅱ.粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,精制时所用的试剂为:①盐酸②氯化钡溶液③氢氧化钠溶液④碳酸钠溶液,以上试剂添加的顺序可以为 .
A.②③④①
B.③④②①
C.④③②①
D.③②④①
(3)Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2 . ①若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是 .
A.分解反应 B.化合反应C.置换反应 D.复分解反应
②若用来提取Br2 , 反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是 .
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁单质处循环
③母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2乙:母液先提取Br2 , 后提取Mg
请你判断哪个更合适?(填“甲”或“乙),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼的熔点为-107.3℃,沸点为12.5℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为B2O3+3C+3Cl2=2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。
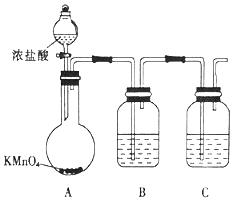
①装置B中盛放的试剂是__,装置C的作用是___________________。
②装置A中发生反应的离子方程式为 _____________________________。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
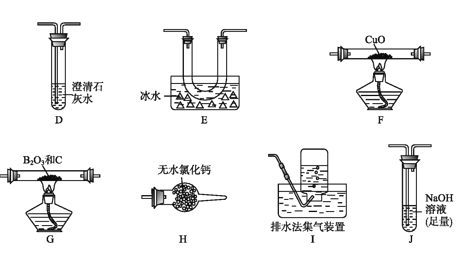
①乙组同学的实验装置中,依次连接的合理顺序为
A→B→C→G→___________→F→D→I。
②能证明反应中有CO生成的现象是___________________________。
③开始实验时,先点燃____(填“F”或“G”)处的酒精灯。
④请写出BCl3水解的化学方程式__________________________。
⑤若实验中制取得到了11.75g BCl3,则理论上消耗12 mol/L的浓盐酸的体积为_________mL(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合物能用溶解、过滤、蒸发三步操作分离的是( )
A. 水和酒精的混合物
B. 氯化钠固体和硝酸钾固体的混合物
C. 氯化钾固体和氯化银固体的混合物
D. 硫酸钡固体和碳酸钡固体的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使pH试纸显深蓝色的溶液中:NH ![]() 、NO
、NO ![]() 、SO42﹣、Na+
、SO42﹣、Na+
B.由水电离的c(H+)=1×10﹣14mol?L﹣1的溶液中:Ca2+、K+、HCO ![]() 、NO
、NO ![]()
C.pH=1的无色溶液中:K+、Fe3+、SO ![]() 、SCN﹣
、SCN﹣
D.![]() =1012的溶液中:Mg2+、Al3+、NO
=1012的溶液中:Mg2+、Al3+、NO ![]() 、Cl﹣
、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 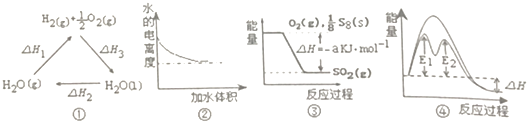
A.图①中△H1=△H2+△H3
B.图②表示0.1molL﹣1氨水加水稀释过程中水的电离度变化曲线
C.图③可知S8燃烧的热化学方程式为S8(s)+8O2(g)=8SO2(g)△H=﹣8akJmol﹣1
D.图④在催化剂条件下,反应的活化能等于E1+E2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种盐X与烧碱混合共热,可放出无色气体Y,Y经一系列氧化后再溶于水可得Z溶液,Y和Z反应又生成X,则X是( )
A.(NH4)2SO4B.NH4NO3
C.NH4ClD.NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,△H1=﹣393.5kJmol﹣1 , △H2=﹣395.4kJmol﹣1 , 下列说法正确的是( ) 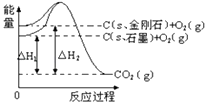
A.金刚石的稳定性强于石墨
B.12g石墨总键能比12g金刚石小1.9kJ
C.石墨和金刚石的转化是物理变化
D.C(s、石墨)=C(s、金刚石)△H=+1.9 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com