
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图: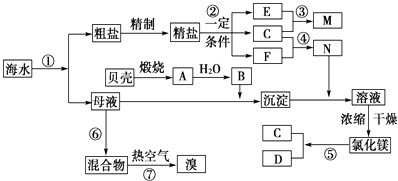
(1)Ⅰ.①写出N的化学式;②写出反应②的化学方程式 .
(2)Ⅱ.粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,精制时所用的试剂为:①盐酸②氯化钡溶液③氢氧化钠溶液④碳酸钠溶液,以上试剂添加的顺序可以为 .
A.②③④①
B.③④②①
C.④③②①
D.③②④①
(3)Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2 . ①若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是 .
A.分解反应 B.化合反应C.置换反应 D.复分解反应
②若用来提取Br2 , 反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是 .
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁单质处循环
③母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2乙:母液先提取Br2 , 后提取Mg
请你判断哪个更合适?(填“甲”或“乙),理由是 .
【答案】
(1)HCl;2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)AD
(3)C;CD;乙;若先提取镁,海水中会残留大量氢氧化钙,再用氯气提取溴单质时会损耗大量氯气
【解析】解:(1)Ⅰ.①根据流程图知:反应2为精盐溶液的电解,反应物是氯化钠和水,产物是氯气、氢气、氢氧化钠,C+F→N,N能溶解沉淀,C既能和F反应又能和E反应,所以,E为NaOH,F为H2 , C为Cl2 , N为HCl,所以答案是:HCl;②电解食盐水时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时生成氢氧化钠,方程式为2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,所以答案是:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,所以答案是:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;(2)Ⅱ.SO
2NaOH+H2↑+Cl2↑;(2)Ⅱ.SO ![]() 、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,试剂添加的顺序可以为②③④①或③②④①,所以答案是:AD;(3)Ⅲ.①液和B反应为海水中的镁离子和氢氧化钙反应,为复分解反应,得到氢氧化镁的沉淀,制取盐酸为化合反应,氢氧化镁和盐酸反应得到氯化镁,为复分解反应,氯化镁电解为分解反应,该过程中未涉及的反应为置换反应,所以答案是:C;②提取Br2 , 反应⑥所用的气态氧化剂为氯气,本厂生产烧碱为电解氯化钠溶液,产物中有氯气,本厂生产镁单质,是电解无水氯化镁,电解氯化镁的产物为镁和氯气,所以答案是:CD;③母液用来提取Mg和Br2 , 若先提取镁,海水中会残留大量Ca(OH)2 , Ca(OH)2能和氯气反应生成氯化钙和次氯酸钙和水,再用Cl2提取溴时会消耗大量Cl2 , 所以乙观点合理,所以答案是:乙;若先提取镁,海水中会残留大量Ca(OH)2 , 再用Cl2提取溴时会消耗大量Cl2 .
、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,试剂添加的顺序可以为②③④①或③②④①,所以答案是:AD;(3)Ⅲ.①液和B反应为海水中的镁离子和氢氧化钙反应,为复分解反应,得到氢氧化镁的沉淀,制取盐酸为化合反应,氢氧化镁和盐酸反应得到氯化镁,为复分解反应,氯化镁电解为分解反应,该过程中未涉及的反应为置换反应,所以答案是:C;②提取Br2 , 反应⑥所用的气态氧化剂为氯气,本厂生产烧碱为电解氯化钠溶液,产物中有氯气,本厂生产镁单质,是电解无水氯化镁,电解氯化镁的产物为镁和氯气,所以答案是:CD;③母液用来提取Mg和Br2 , 若先提取镁,海水中会残留大量Ca(OH)2 , Ca(OH)2能和氯气反应生成氯化钙和次氯酸钙和水,再用Cl2提取溴时会消耗大量Cl2 , 所以乙观点合理,所以答案是:乙;若先提取镁,海水中会残留大量Ca(OH)2 , 再用Cl2提取溴时会消耗大量Cl2 .


科目:高中化学 来源: 题型:
【题目】如图,图1表示白磷(P4)的分子结构,图2表示三氧化二磷(P4O6)的分子结构,图3表示五氧化二磷(P4O10)的分子结构,下列说法中正确的是( ) 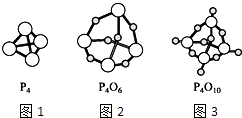
A.P4O6中的磷原子采用sp2方式杂化
B.三氧化二磷、五氧化二磷这两个名称都表示分子的实际组成
C.P4、P4O6和P4O10分子中同一P原子上两个化学键之间的夹角都是60°
D.P4O6分子中4个P原子构成正四面体,6个O原子构成正八面体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在离子化合物中,可能含共价键
B.含离子键的化合物不一定是离子化合物
C.在共价化合物中,可能含离子键
D.含共价键的化合物一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
(1)Z2的电子式为_________,Y的原子结构示意图为________,YW2的结构式为________。
(2)将X2、W2 按下图所示通入某燃料电池中,其中,b电极的电极反应式为________。若有16gW2参加反应,转移的电子数是_______NA。
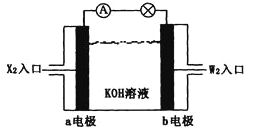
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,13g某气体所含的分子数与14gCO 所含的分子数相等。此气体在标准状况下的密度为( )
A. 1.25g·L-1 B. 2.32 g·L-1 C. 1.65 g·L-1 D. 1.16 g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 同温同压下,相同体积的两物质,它们的物质的量必相等
B. 任何条件下,等物质的量的氮气和一氧化碳所含的分子数必相等
C. 1L一氧化碳气体的质量一定比1L氧气的质量要小
D. 等体积、等物质的量浓度的强酸中所含的H+数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一真空储气瓶质量为400g,在相同条件下,装满O2时质量为404克,装满另一种气体X时质量为405.5克,则X的相对分子质量为( )
A. 44 B. 64 C. 71 D. 48
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃煤和汽车尾气是造成空气污染和雾霾天气的原因之一,化学在解决雾霾污染中发挥了重要作用。
(1)NOx主要来源于汽车尾气。
已知:N2(g) + 2O2(g)![]() 2NO2(g) ΔH=+67.5kJ/mol
2NO2(g) ΔH=+67.5kJ/mol
2CO(g) + O2(g)![]() 2CO2(g) ΔH=-566.0kJ/mol。
2CO2(g) ΔH=-566.0kJ/mol。
为了减轻大气污染,在汽车尾气排气管口采用催化剂将NO2和CO转化成无污染气体参与大气循环。写出该反应的热化学方程式_____________。
(2)已知:5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s),工业上可以利用I2O5消除CO的污染。不同温度下,向装有足量I2O5固体的4 L恒容密闭容器中通入2 mol CO,测得CO2的体积分数随时间变化的曲线如图。回答下列问题:
5CO2(g)+I2(s),工业上可以利用I2O5消除CO的污染。不同温度下,向装有足量I2O5固体的4 L恒容密闭容器中通入2 mol CO,测得CO2的体积分数随时间变化的曲线如图。回答下列问题:
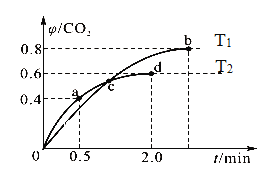
①从反应开始至a点时,v(CO)=___________。
②由图可知,该反应的ΔH________0(填“大于”或“小于”),b点时化学平衡常数K=___________。
③下列说法正确的是___________(填字母)。
A.d点时,增大体系压强,CO的转化率变大
B.容器内气体密度不变时,表明反应达到平衡状态
C.c点时体系中混合气体的压强在T2温度下更大
D.b点时,向平衡体系中再加入I2O5,平衡向正反应方向移动
(3)电解吸收是脱硝的一种方法。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。
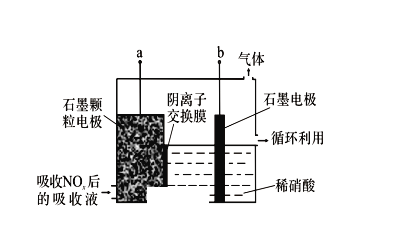
①图中b应连接电源的___________(填“正极”或“负极”)。
②阳极的电极反应式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com