
【题目】下列说法正确的是( )
A.在离子化合物中,可能含共价键
B.含离子键的化合物不一定是离子化合物
C.在共价化合物中,可能含离子键
D.含共价键的化合物一定是共价化合物
科目:高中化学 来源: 题型:
【题目】下列有关化学用语的使用正确的是( )
A.Cl2通入石灰乳中制漂白粉的离子方程式:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.利用泡沫灭火器灭火时发生的反应:2Al3++CO32﹣+3H2O═2Al(OH)3↓+CO2↑
C.已知离子的还原性:Sn2+>Fe2+ , 则可推测在溶液中能发生如下反应:Sn4++2Fe2+═2Fe3++Sn2+
D.298 K时,已知12g石墨完全燃烧生成CO2(g)放出393.5kJ热量,1mol CO完全燃烧放出283.5kJ热量,则一定有:C(s,石墨)+ ![]() O2(g)═CO(g)△H=﹣110 kJ?mol﹣1
O2(g)═CO(g)△H=﹣110 kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体),下列分析或结果错误的是
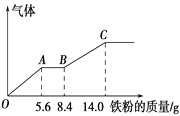
A. 原混合酸中HNO3的物质的量为0.1 mol
B. OA段产生的是NO,AB段的反应为Fe+2Fe3+ == 3Fe2+,BC段产生氢气
C. 第二份溶液中最终溶质为FeSO4
D. H2SO4浓度为2.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
Z(g) △H<0,反应经60s达到平衡并生成0.3 mol Z,则下列说法中正确的是
A. 以Y浓度变化表示的反应速率为0.0005 mol/(L·s)
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的1/2
C. 其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
D. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋是一种绿色稀有金属,铋及其化合物在工业生产中用途广泛,工业上常采用粗铋精炼制得用途更为广泛的精炼铋(含铋99.995%),火法精炼铋的工艺流程如下:
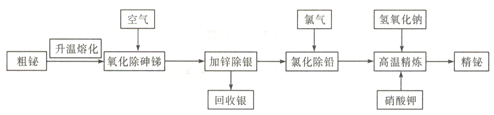
已知:①粗铋(铅铋合金)的主要化学成分如下表:
元素 | Ag | Bi | Pb | As | Sb |
含量/% | 0.90 | 55.25 | 27 | 1.30 | 11 |
②氯化铅熔点为498℃,密度为5.9g/cm3;铋的熔点为271℃,沸点为1470℃;BiCl3的熔点为506.5℃。
③锌酸盐简写成ZnO22-,如锌酸钠Na2ZnO2。
④+3价铋的化合物较为稳定,铋酸钠难溶于水。
回答下列问题:
(1)实验室中升温熔化粗铋一般用酒精喷灯在________(填主要仪器名称)中完成。
(2)NaBiO3中铋元素的化合价为________。
(3)“氧化除砷锑”的工艺机理是粗铋熔融液在680~750℃的条件下,鼓入压缩空气,使砷、锑氧化挥发,同时空气也与铋液反应,利用Bi2O3的_______性将杂质砷、锑转变成As2O3、Sb2O3而除去。
(4)“氯化除铅”过程中,氯气与铅、铋反应分别生成PbCl2、BiCl3,生成的BiCl3又会被铅还原,发生反应3Pb+2BiCl3=3PbC12+2Bi,控制温度350-400℃,利用熔点和密度特点,氯化铅上浮至铋液表面呈_______态覆盖,防止氯气__________________。
(5)高温精炼的实质为碱性精炼,加入少量KNO3和NaOH,将锌氧化成锌酸盐而除去残锌,同时得到氮气,写出高温精炼的化学方程式: __________________。
(6)向含有MnSO4的酸性溶液中加入铋酸钠粉末,溶液变为紫红色,该反应经常用来检验Mn2+,写出该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象及相关的离子方程式均正确的是( )
A.Cl2与FeI2溶液反应,当n(Cl2):n(FeI2)=1:1时:2Fe2++2I﹣+2Cl2=2Fe3++I2+4Cl﹣
B.向Ba(NO3)2溶液中通人SO2气体,出现白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+
C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2 MnO4+7 H2O2+6 H+=2Mn2++6O2↑+10 H2O
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO ![]() +H++OH﹣=BaSO4↓+H2O
+H++OH﹣=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图: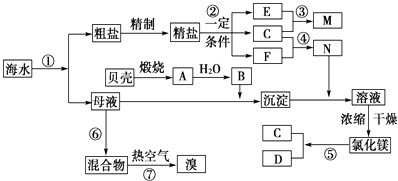
(1)Ⅰ.①写出N的化学式;②写出反应②的化学方程式 .
(2)Ⅱ.粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,精制时所用的试剂为:①盐酸②氯化钡溶液③氢氧化钠溶液④碳酸钠溶液,以上试剂添加的顺序可以为 .
A.②③④①
B.③④②①
C.④③②①
D.③②④①
(3)Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2 . ①若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是 .
A.分解反应 B.化合反应C.置换反应 D.复分解反应
②若用来提取Br2 , 反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是 .
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁单质处循环
③母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2乙:母液先提取Br2 , 后提取Mg
请你判断哪个更合适?(填“甲”或“乙),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 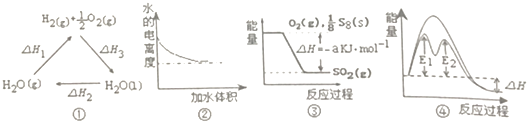
A.图①中△H1=△H2+△H3
B.图②表示0.1molL﹣1氨水加水稀释过程中水的电离度变化曲线
C.图③可知S8燃烧的热化学方程式为S8(s)+8O2(g)=8SO2(g)△H=﹣8akJmol﹣1
D.图④在催化剂条件下,反应的活化能等于E1+E2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com