
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)从海水中提取镁的流程如图所示:
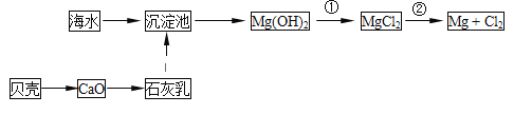
反应①的离子方程式为__;
反应②的化学方程式为__;
(2)海水提取溴流程:
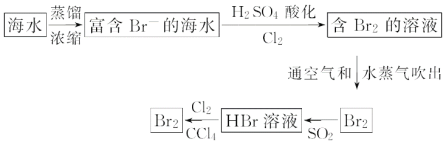
①该流程中涉及发生反应的离子方程式: __; ___;
②该流程中溴元素被氧化又被还原又被氧化的目的是:___;
③从最终溴的四氯化碳溶液中得到液溴,应采取的操作是__。
【答案】Mg(OH)2+2H+=Mg2++2H2O MgCl2(熔融)![]() Mg+Cl2↑ Cl2+2Br- =Br2+2Cl- Br2+SO2+2H2O=4H++2Br- + SO42- 富集溴元素 蒸馏
Mg+Cl2↑ Cl2+2Br- =Br2+2Cl- Br2+SO2+2H2O=4H++2Br- + SO42- 富集溴元素 蒸馏
【解析】
(1)根据对应步骤写出对应的化学方程式或离子方程式;
(2)根据流程分析可知,浓缩海水中通入氧化剂氯气氧化溴离子为单质溴,得到低浓度Br2的溶液,通入热空气或水蒸气吹出Br2,用二氧化硫水溶液吸收得到含HBr的溶液,再用氯气氧化溴离子得到单质溴,用四氯化碳萃取溴单质,再进行蒸馏得到单质溴,据此解答。
(1)反应①是Mg(OH)2与盐酸反应生成氯化镁和水,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O;反应②是电解熔融MgCl2,反应的化学方程式为:MgCl2(熔融)![]() Mg+Cl2↑;
Mg+Cl2↑;
故答案为:Mg(OH)2+2H+=Mg2++2H2O;MgCl2(熔融)![]() Mg+Cl2↑;
Mg+Cl2↑;
(2)①根据流程分析可知,浓缩海水中通入氧化剂氯气氧化溴离子为单质溴,得到低浓度Br2的溶液,通入热空气或水蒸气吹出Br2,用二氧化硫水溶液吸收得到含HBr的溶液,再用氯气氧化溴离子得到单质溴,用四氯化碳萃取溴单质,再进行蒸馏得到单质溴,因此涉及发生的反应包括:氯气氧化溴离子,Br2与SO2、H2O反应生成氢溴酸和硫酸,反应的离子方程式为:Cl2+2Br- =Br2+2Cl-;Br2+SO2+2H2O=4H++2Br- + SO42-;
故答案为:Cl2+2Br- =Br2+2Cl-;Br2+SO2+2H2O=4H++2Br- + SO42-;
②该流程中溴元素被氧化又被还原又被氧化的目的是富集溴元素;
故答案为:富集溴元素;
③溴易溶于四氯化碳,则可用蒸馏的方法从溴的四氯化碳溶液中得到液溴;
故答案为:蒸馏。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
A.1:1B.108:1C.5×109:1D.1010:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。

下列说法不正确的是_____________ (填字母序号)。
a. pH=8时,溶液中含碳元素的微粒主要是HCO3-
b. A点,溶液中H2CO3和HCO3-浓度相同
c. 当c(HCO3-)=c(CO32-)时,c(H+)>c(OH-)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是_____________。
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH-可以吸收烟道气中的CO2,同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:_____________。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程产物中有CO2和_____________。
(3)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是_____________。
②上述方式使处理后海水pH升高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在KI溶液中存在平衡
在KI溶液中存在平衡![]() 。某
。某![]() 、KI混合溶液中,
、KI混合溶液中,![]() 的物质的量浓度
的物质的量浓度![]() 与温度T的关系如图所示
与温度T的关系如图所示![]() 曲线上的任何一点都表示平衡状态
曲线上的任何一点都表示平衡状态![]() 。下列说法正确的是( )
。下列说法正确的是( )

①![]()
②若温度为![]() 、
、![]() 时反应的平衡常数分别为
时反应的平衡常数分别为![]() 、
、![]() ,则
,则![]()
③若反应进行到状态D时,一定有![]()
④状态A与状态B相比,状态A的![]() 大
大
⑤保持温度不变,向该混合溶液中加水,![]() 将变大
将变大
A.只有①②B.只有②③C.①③④D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置进行乙醇氧化反应的探究实验,有关说法不正确的是()
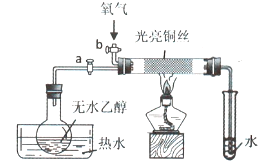
A.热水的作用是促使乙醇挥发,为硬质玻璃管内提供乙醇蒸汽
B.通入乙醇蒸汽反应的过程中,撤离酒精灯后反应仍能进行
C.在硬质玻璃管内发生的主反应为:![]()
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2的工艺如下:

己知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为___,该新方法最突出的优点是___。
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③___;④低于60℃干燥,得到产品。
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶势、充分反应后(ClO2-被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.25mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度___。(提示:2Na2S2O3+I2=Na2S4O6+2Nal)
(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定25℃各含氯微粒浓度随pH的变化情况如图所示(Cl-没有画出)。

①酸性条件下NaClO2溶液中存在的Cl-原因是___(用离子方程式解释)。
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)C是______溶液,D是______溶液。
(2)100mL0.01molL﹣1的B溶液与10mL 0.1molL﹣1的B溶液相比较,下列数值中,前者大于后者的是______ (填写序号)
①![]() ②
②![]() ③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,相同pH的两种一元酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )

A. HA一定是强酸
B. a点溶液的导电性大于b点溶液
C. a点的c(HA)大于b点的c(HB)
D. HA的酸性强于HB
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com