
【题目】![]() 在KI溶液中存在平衡
在KI溶液中存在平衡![]() 。某
。某![]() 、KI混合溶液中,
、KI混合溶液中,![]() 的物质的量浓度
的物质的量浓度![]() 与温度T的关系如图所示
与温度T的关系如图所示![]() 曲线上的任何一点都表示平衡状态
曲线上的任何一点都表示平衡状态![]() 。下列说法正确的是( )
。下列说法正确的是( )

①![]()
②若温度为![]() 、
、![]() 时反应的平衡常数分别为
时反应的平衡常数分别为![]() 、
、![]() ,则
,则![]()
③若反应进行到状态D时,一定有![]()
④状态A与状态B相比,状态A的![]() 大
大
⑤保持温度不变,向该混合溶液中加水,![]() 将变大
将变大
A.只有①②B.只有②③C.①③④D.①③⑤
【答案】B
【解析】
①由图象曲线的变化趋势可知,当温度升高时,![]() 的物质的量浓度减小,说明该反应的正反应为放热反应,反应
的物质的量浓度减小,说明该反应的正反应为放热反应,反应![]() 的
的![]() ,故①错误;
,故①错误;
②该反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,温度越高,平衡常数越小,若温度为![]() 、
、![]() ,反应的平衡常数分别为
,反应的平衡常数分别为![]() 、
、![]() ,则
,则![]() ,故②正确;
,故②正确;
③若反应进行到状态D时,反应未达到平衡状态,若反应趋向于平衡,则反应向生成的![]() 方向移动,则
方向移动,则![]() ,故③正确;
,故③正确;
④状态A与状态B相比,B状态相当于在A的基础上升高温度,平衡向逆反应方向移动,则状态B的![]() 大,故④错误;
大,故④错误;
⑤保持温度不变,则平衡常数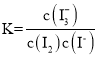 不变,
不变, 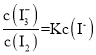 ,在该混合液中加水,各物质的浓度均减小,则
,在该混合液中加水,各物质的浓度均减小,则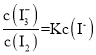 减小,故⑤错误;
减小,故⑤错误;
②③正确。
故答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】反应 2NO2(g)![]() N2O4(g) △H<0,在温度分别为T1、T2 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
N2O4(g) △H<0,在温度分别为T1、T2 时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
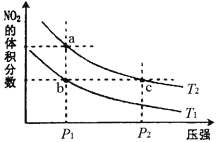
A.a、c两点的反应速率:a>c
B.a、c两点NO2的转化率:a>c
C.b、c两点的化学平衡常数:b=c
D.由状态b到状态a,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3溶液/mL | H2O/mL | 反应温度/°C | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
(1)实验①②是探究_______________对反应速率的影响,表中t1_________t2(填“>”、“=”或“<”);实验①③是探究温度对反应速率的影响,表中a=_________,b=_________。
(2)改变反应温度,重复实验③,得到溶液变蓝所需时间(t)与温度(T)的关系如图所示(超过50°C后溶液不会再变蓝)。a、b、c、d四点中,反应速率最快的是_________。(填选项)
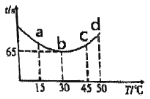
A.a点 B.b点 C.c点 D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g)![]() CH3OH(g) H1=90.1kJ·mol1
CH3OH(g) H1=90.1kJ·mol1
ii.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是
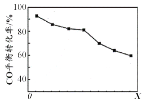
A . 由H2和CO直接制备二甲醚的反应为放热反应
B. 条件X为压强
C. X增大,二甲醚的产率一定增大
D. X增大,该反应的平衡常数一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热聚丙烯废塑料可以得到炭、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废塑料的再利用。下列叙述中不正确的是( )

A.装置乙的试管中可收集到芳香烃B.装置丙中的试剂可吸收烯烃
C.最后收集的气体可作燃料D.该实验是聚丙烯发生加聚反应的实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。下列说法错误的是
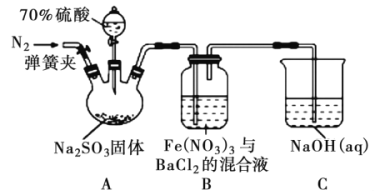
A. 装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B. 实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C. 三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D. 装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)从海水中提取镁的流程如图所示:
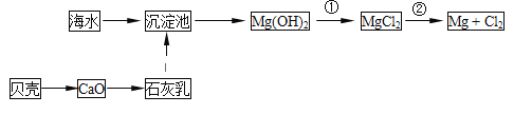
反应①的离子方程式为__;
反应②的化学方程式为__;
(2)海水提取溴流程:
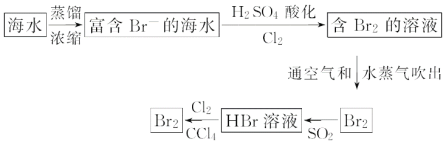
①该流程中涉及发生反应的离子方程式: __; ___;
②该流程中溴元素被氧化又被还原又被氧化的目的是:___;
③从最终溴的四氯化碳溶液中得到液溴,应采取的操作是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某HCl溶液的物质的量浓度,可用0.1000mol·L-1NaOH标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
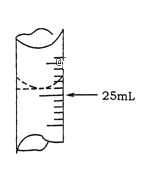
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为 ___________;
(2)乙学生做了三组平行实验,数据记录如下:
实验 序号 | 待测HCl溶液的体积/mL | 0.1000mol·L-1NaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.11 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出HCl待测溶液的物质的量浓度为 ________mol·L-1(小数点后保留四位);
(3)滴定时的正确操作是_____________________________________________________。滴定达到终点的现象是_____________________________________________;此时锥形瓶内溶液的pH的范围是________。
(4)下列哪些操作会使测定结果偏高_______________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前碱式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中﹣lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
(已知:Ksp(ZnS)=3×10﹣25mol2/L2)

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=10﹣35.4mol2/L2
D. 向100 mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com