
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3溶液/mL | H2O/mL | 反应温度/°C | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
(1)实验①②是探究_______________对反应速率的影响,表中t1_________t2(填“>”、“=”或“<”);实验①③是探究温度对反应速率的影响,表中a=_________,b=_________。
(2)改变反应温度,重复实验③,得到溶液变蓝所需时间(t)与温度(T)的关系如图所示(超过50°C后溶液不会再变蓝)。a、b、c、d四点中,反应速率最快的是_________。(填选项)
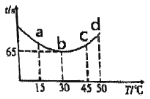
A.a点 B.b点 C.c点 D.d点
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) H<0。当改变某个条件并达到新平衡后,下列叙述不正确的是( )
2Z(g) H<0。当改变某个条件并达到新平衡后,下列叙述不正确的是( )
A.升高温度;X的体积分数增大
B.增大压强(缩小容器体积),Z的物质的量不变
C.保持容器体积不变,充入稀有气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
A.1:1B.108:1C.5×109:1D.1010:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据美国《科学》杂志报道,外太空的某一星球的大气层中,含有大量的CH2=CHOH,此物质常温时为液体,它很容易转化成CH3CHO,化学方程式为CH2=CHOH![]() CH3CHO;已知ΔH<0。据此你认为下列说法中错误的是
CH3CHO;已知ΔH<0。据此你认为下列说法中错误的是
A.该星球表面温度很高B.该星球表面温度很低
C.该反应为放热反应D.高温下稳定性CH2=CHOH>CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究与深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁。高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下:
温度/°C | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
则该反应的平街常数表达式K=_________,H_________0(填“>”、“<”或“=”)。
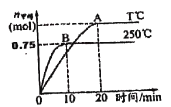
(2)CO2可用于生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
CH3OH(g)+H2O(g),为探究该反应原理,将1 mol CO2和3 mol H2充入一容积为1L的密闭容器中,分别在250°C、T°C下发生反应,测得甲醇的物质的量随时间的变化如下图所示。
请分析并回答下列问题:
250°C时,反应在前10min的平均速率v(H2)_________molL-1min-1,从反应开始到平衡,CO2转化率为_________%。相同温度下,若某时刻该容器中含有1 mol H2、1.2mol CO2、0.8mol CH3OH、1.5 mol H2O,则此时反应所处的状态为____________________________________(填“向正反应方向进行中”、“向逆反应方向进行中心”或“平衡状态”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减小![]() 对环境的影响,在倡导“低碳”的同时,还需加强对
对环境的影响,在倡导“低碳”的同时,还需加强对![]() 创新利用的研究.
创新利用的研究.![]() 时,将
时,将![]() 和
和![]() 充入3L密闭容器中,发生反应
充入3L密闭容器中,发生反应![]() ,
,![]() ,容器中
,容器中![]() 的物质的量随时间变化如曲线I所示,平衡时容器内压强为仍为
的物质的量随时间变化如曲线I所示,平衡时容器内压强为仍为![]() ,改变某一条件重新进行上述反应,
,改变某一条件重新进行上述反应,![]() 的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是( )
的物质的量随时间变化如曲线Ⅱ所示。下列说法错误的是( )
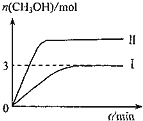
A.曲线Ⅱ对应的条件改变是增大压强
B.![]() 时,上述反应平衡常数为
时,上述反应平衡常数为![]() ,则
,则![]()
C.在![]() ,若起始时向容器中充入5mol
,若起始时向容器中充入5mol![]() 、5mol
、5mol![]() 、5mol
、5mol![]() 和5mol
和5mol![]() ,则达平衡前
,则达平衡前![]() 正
正![]() 逆
逆![]()
D.在![]() ,若起始时向容器由充入
,若起始时向容器由充入![]() 、6mol
、6mol![]() ,平衡时容器内压强
,平衡时容器内压强![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。

下列说法不正确的是_____________ (填字母序号)。
a. pH=8时,溶液中含碳元素的微粒主要是HCO3-
b. A点,溶液中H2CO3和HCO3-浓度相同
c. 当c(HCO3-)=c(CO32-)时,c(H+)>c(OH-)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是_____________。
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH-可以吸收烟道气中的CO2,同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:_____________。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程产物中有CO2和_____________。
(3)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是_____________。
②上述方式使处理后海水pH升高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在KI溶液中存在平衡
在KI溶液中存在平衡![]() 。某
。某![]() 、KI混合溶液中,
、KI混合溶液中,![]() 的物质的量浓度
的物质的量浓度![]() 与温度T的关系如图所示
与温度T的关系如图所示![]() 曲线上的任何一点都表示平衡状态
曲线上的任何一点都表示平衡状态![]() 。下列说法正确的是( )
。下列说法正确的是( )

①![]()
②若温度为![]() 、
、![]() 时反应的平衡常数分别为
时反应的平衡常数分别为![]() 、
、![]() ,则
,则![]()
③若反应进行到状态D时,一定有![]()
④状态A与状态B相比,状态A的![]() 大
大
⑤保持温度不变,向该混合溶液中加水,![]() 将变大
将变大
A.只有①②B.只有②③C.①③④D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH 、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1 L pH=3的A溶液分别与0.001mol·L-1 xL B溶液、0.001mol·L-1 yL D溶液充分反应至中性,x、y大小关系为: y<x;
②浓度均为0.1mol·L-1A和E溶液,pH:A<E;
③浓度均为0.1mol·L-1C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)C是______溶液,D是______溶液。
(2)100mL0.01molL﹣1的B溶液与10mL 0.1molL﹣1的B溶液相比较,下列数值中,前者大于后者的是______ (填写序号)
①![]() ②
②![]() ③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
③ c(H+)和c(OH-)的乘积 ④ OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E ④反应过程的平均速率 E>A
⑤A溶液里有锌粉剩余 ⑥E溶液里有锌粉剩余
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com