
【题目】下列图示与对应的叙述相符的是( )
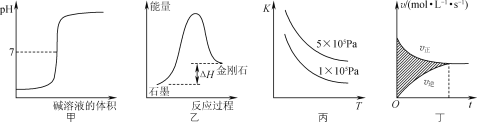
A. 图甲所示,表示强碱滴定强酸的滴定曲线
B. 图乙所示,从能量角度考虑,金刚石比石墨稳定
C. 图丙所示,表示反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0的平衡常数K与温度和压强的关系
2SO3(g);ΔH<0的平衡常数K与温度和压强的关系
D. 图丁所示,图中的阴影部分面积的含义是[υ(正)-υ(逆)]
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,能说明反应X2(g)+Y2(g)![]() 2XY(g)已达到平衡的是
2XY(g)已达到平衡的是
A. 容器内的总压不随时间变化B. 容器中气体的平均相对分子质量不随时间变化
C. XY气体的物质的量分数不变D. X2和Y2的消耗速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)催化转化器可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
已知:N2(g)+O2(g)=2NO(g) △H1=+180.5 kJ/mol;
2C(s)+O2(g)=2CO(g) △H2=-221.0 kJ/mol;
C(s)+O2(g)=CO2(g) △H3=-393.5 kJ/mol
则尾气转化反应2NO(g) +2CO(g)=N2(g)+2CO2(g)的△H=___________。
(2)氨是一种重要的化工原料,在工农业生产中有广泛的应用。在773 K时,分别将2.00 mol N2和6.00 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间(t)的关系如表所示:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
①该温度下,若向同容积的另一容器中投入N2、H2、NH3,其浓度均为3 mol/L,则此时v正____v逆(填“大于”“小于”或“等于”)。
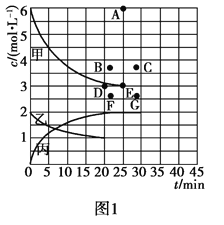
②由表中的实验数据可得到“c—t”的关系,如图1所示,表示c(N2)—t的曲线是______。在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)—t的曲线上相应的点为________。
![]() N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图2所示:
N2(g)+CO2(g) △H=-34.0kJ/mol,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图2所示:
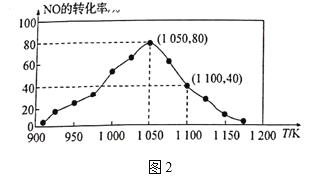
①由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为_______;在1100K时,CO2的体积分数为__________。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=______[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
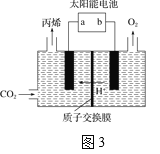
(4)在酸性电解质溶液中,以惰性材料作电极,将CO2转化为丙烯的原理如图3所示
①太阳能电池的负极是_______(填“a”或“b”)
②生成丙烯的电极反应式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 1 molN2与4molH2混合充分反应,则转移的电子数目为6mol
B. 向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中![]() 减小
减小
C. 常温下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
D. HCl和NaOH反应的中和热为-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热为-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中铋元素的数据见图,下列说法不正确的是( )

A. 铋原子s轨道的形状是球形的,p轨道的形状是哑铃形
B. 铋元素的相对原子质量是209.0
C. 铋原子6p能级中6px、6py、6pz轨道上各有一个电子
D. 铋原子最外层有5个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中的氮氧化物是造成大气污染的重要因素。
(1)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
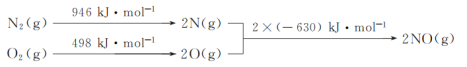
则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为___。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1所示。
①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____。
②NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示。请写出NO分解的化学方程式:______。

(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验,实验结果如图3。
①同时脱硫脱硝时NO的氧化率略低的原因是____。
②由图3可知SO2对NO的氧化率影响很小的原因是_____。
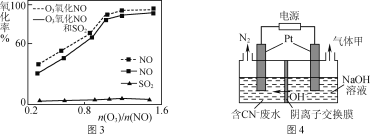
(4)有人设想采用下列方法减少烟气中的氮氧化物对环境的污染:用天然气中的CH4、H2等还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NOx。请写出这种含硫化合物和NOx反应的化学方程式:_____。
(5)某工业废水中含有毒性较大的CN-,可用电解法将其转变为N2,装置如图4所示。电解池中生成N2的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺流程如下:(已知溶液D中通入过量的CO2得到白色沉淀)

请回答下列问题:
(1)操作Ⅰ的名称为________。
(2)不溶物A是_________________(填化学式),写出A与氢氧化钠溶液反应的离子方程式_________________________________。
(3)+3价的铝常或多或少地置换硅酸盐中+4价的硅而形成铝硅酸盐。已知某种铝硅酸盐主要成分的化学式为Al2Si2O5(OH)4,请将其改写成氧化物的组合形式________。
(4)溶液D中Al元素的主要存在形式为_____________(填离子符号)
(5)写出E→G的化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液 ![]()
![]() 粗盐
粗盐
第①步的操作是________,第⑤步的操作是________, 第⑦步置于________(填仪器的名称)中进行。
(2)4.5g水与_____g磷酸(H3PO4)所含的分子数相等,它们所含的氧原子数之比是_______。
(3)质量都是50g 的Cl2、NH3、CO2、O2 四种气体中,含有分子数最少的是________;在相同的温度和压强下,体积最大的是________。
(4)今有0.1mol/L NaCl溶液300mL,0.1mol/L MgCl2溶液200mL和0.1mol/LAlCl3溶液100mL,这三种溶液中氯离子浓度之比是_______________。
(5)实验室需要配制480mL 1mol/L H2SO4溶液,需要质量分数为98%,密度为1.84g/cm3的浓H2SO4________mL(保留一位小数),配制时用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有两种仪器分别是________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
T(K) | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量______;充入氦气,混合气体的密度____(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①用等式表示Na2CO3溶液中含有H+ 、OH- 、HCO3-、H2CO3微粒间的关系_________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com