
【题目】按要求填空
(1)为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液 ![]()
![]() 粗盐
粗盐
第①步的操作是________,第⑤步的操作是________, 第⑦步置于________(填仪器的名称)中进行。
(2)4.5g水与_____g磷酸(H3PO4)所含的分子数相等,它们所含的氧原子数之比是_______。
(3)质量都是50g 的Cl2、NH3、CO2、O2 四种气体中,含有分子数最少的是________;在相同的温度和压强下,体积最大的是________。
(4)今有0.1mol/L NaCl溶液300mL,0.1mol/L MgCl2溶液200mL和0.1mol/LAlCl3溶液100mL,这三种溶液中氯离子浓度之比是_______________。
(5)实验室需要配制480mL 1mol/L H2SO4溶液,需要质量分数为98%,密度为1.84g/cm3的浓H2SO4________mL(保留一位小数),配制时用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有两种仪器分别是________、____________。
【答案】溶解 过滤 蒸发皿 24.5 1:4 Cl2 NH3 1:2:3 27.2 胶头滴管 500 mL容量瓶
【解析】
(1)粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,先溶解,在加入试剂除去离子。
(2)微粒分子数之比等于物质的量之比。
(3)根据物质的量计算公式![]() 、V=n×Vm解决问题。
、V=n×Vm解决问题。
(4)溶液中离子的浓度与溶液的体积无关。
(5)配制一定浓度的溶液需要用到的仪器有量筒、烧杯、玻璃棒、胶头滴管、容量瓶。
(1)为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液 ![]()
![]() 粗盐
粗盐
除杂要在溶液中进行,故第①步操作是溶解,加入试剂后将杂质离子转化为沉淀,故第⑤步的操作是过滤,第⑦步为蒸发结晶,蒸发应该在蒸发皿中进行。
(2)4.5g水中水分子的物质的量为0.25mol,磷酸(H3PO4)所含的分子的物质的量也为0.25mol,磷酸(H3PO4)的质量为![]() ,则0.25molH2O中氧原子的个数为0.25NA,0.25mol H3PO4中氧原子数为0.25mol×4NA=NA,故两者所含的氧原子数之比是1:4。
,则0.25molH2O中氧原子的个数为0.25NA,0.25mol H3PO4中氧原子数为0.25mol×4NA=NA,故两者所含的氧原子数之比是1:4。
(3)根据![]() 可知,质量相同时,摩尔质量越大,n越小,分子数目越小, Cl2、NH3、CO2、O2 四种气体中摩尔质量最大的是Cl2,故Cl2含有分子数最少;根据V=n×Vm可知,温度和压强相同时Vm相同,则物质的量越大,体积越大,综上分析相同质量的四种气体中,NH3摩尔质量最小,故其物质的量最大,体积也最大。
可知,质量相同时,摩尔质量越大,n越小,分子数目越小, Cl2、NH3、CO2、O2 四种气体中摩尔质量最大的是Cl2,故Cl2含有分子数最少;根据V=n×Vm可知,温度和压强相同时Vm相同,则物质的量越大,体积越大,综上分析相同质量的四种气体中,NH3摩尔质量最小,故其物质的量最大,体积也最大。
(4)0.1mol/L NaCl溶液中氯离子浓度为0.1mol/L,0.1mol/L MgCl2溶液中氯离子浓度为0.2mol/L,0.1mol/LAlCl3溶液中氯离子浓度为0.3mol/L,故这三种溶液中氯离子浓度之比是1:2:3。
(5)配制480mL 1mol/L H2SO4溶液,需要选择500mL容量瓶,根据公式![]() 计算,98%,密度为1.84g/cm3的浓H2SO4的物质的量浓度
计算,98%,密度为1.84g/cm3的浓H2SO4的物质的量浓度![]() ,因稀释前后溶质的物质的量不变,故c1×V1=c2×V2,
,因稀释前后溶质的物质的量不变,故c1×V1=c2×V2,![]() 。配制时用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有两种仪器分别是胶头滴管、500mL容量瓶。
。配制时用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有两种仪器分别是胶头滴管、500mL容量瓶。


科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
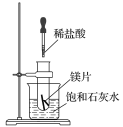
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
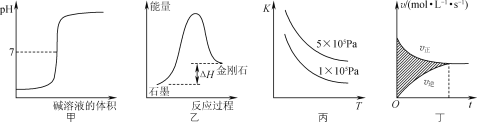
A. 图甲所示,表示强碱滴定强酸的滴定曲线
B. 图乙所示,从能量角度考虑,金刚石比石墨稳定
C. 图丙所示,表示反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0的平衡常数K与温度和压强的关系
2SO3(g);ΔH<0的平衡常数K与温度和压强的关系
D. 图丁所示,图中的阴影部分面积的含义是[υ(正)-υ(逆)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2]。下列有关说法正确的是( )
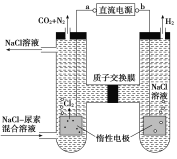
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 除去尿素的反应为:CO(NH2)2+2Cl2+H2O== N2+CO2+4HCl
D. 若两极共收集到气体0.6mol,则除去的尿素为0.12mol(忽略气体溶解,假设氯气全部参与反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在120℃的条件下,将体积比为1:1总质量为7.2g的CO与H2的混合气体在足量的O2中充分燃烧,然后将产生的气体通过足量的Na2O2固体中充分反应,反应后固体增加的质量为( )
A.4.5 gB.7.2 gC.9.3 gD.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如图所示:
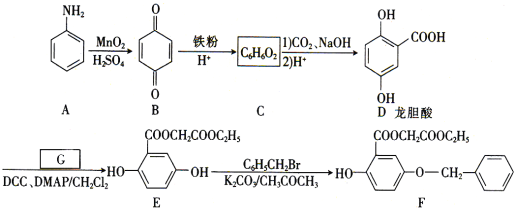
(1)A的分子式是______,B中含有的官能团的名称是_________。
(2)D→E的反应类型是_______。
(3)已知G能与金属钠反应,则G的结构简式为_________。
(4)写出E→F的化学方程式:_________。
(5)写出符合下列条件的龙胆酸乙酯(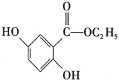 )的同分异构体有______种,写出其中一种同分异构体的结构简式:_________________ 。
)的同分异构体有______种,写出其中一种同分异构体的结构简式:_________________ 。
①能发生银镜反应,与FeCl3溶液不发生显色反应,但水解产物之一能与FeCl3溶液发生显色反应;②核磁共振氢谱有四组峰,且峰的面积之比为6:2:1:1。
(6)已知: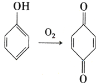 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(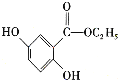 )的合成路线(无机试剂任用):________。
)的合成路线(无机试剂任用):________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常见四种有机物的比例模型示意图。下列说法不正确的是( )
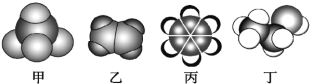
A. 甲不能使酸性高锰酸钾溶液和溴水均褪色
B. 乙可使酸性高锰酸钾溶液和溴水均褪色,且反应类型也相同.
C. 丙不能使酸性高锰酸钾溶液和溴水反应而褪色
D. 丁能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验溶液中是否含有Cl-,某同学采用向溶液中先加HNO3,再加AgNO3,溶液的实验方案,若有白色沉淀生成,则证明有Cl-。对此结论,有人提出了质疑,设计了如下探究性实验。
实验一:向Na2SO4溶液中滴加AgNO3溶液
编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
体积/mL | 浓度/(mol·L-1) | 体积/滴 | 浓度/(mol·L-1) | ||
① | 1 | l | 3 | 2 | 出现大量白色沉淀 |
② | 1 | 1 | 3 | 0.5 | 出现少量白色沉淀 |
③ | 1 | 1 | 3 | 0.1 | 有些许浑浊 |
④ | 1 | 1 | 3 | 0.0l | 无明显变化 |
(1)实验一中产生沉淀的离子方程式为______。
(2)学生设计了如下表格,对实验一内容进行理论计算,请帮他完成表格。(表中不要留空格)。
[25℃时Ksp(Ag2SO4)=1.2×10-5,Ksp(AgCl)=1.8×10-10]
编号 | AgNO3浓度/(mol·L-1) | 稀释后Ag+浓度/(mol·L-1) | 混合液中SO42-的最小理论检出浓度/(mol·L-1) |
① | 2 | 0.2 | 0.0003 |
② | 0.5 | _______ | 0.0048 |
③ | 0.1 | 0.0l | 0.12 |
④ | _______ | 0.001 | _________ |
若向lmL某溶液中加入3滴0.1mol/LAgNO3溶液,分析上面数据,判断下列说法正确的是__ (填字母序号)。
A.混合液中c(SO42-)=0.1mol/L时不会产生Ag2SO4沉淀
B.混合液中c(SO42-)=1mol/L时不会产生Ag2SO4沉淀
C.无论SO42-浓度大小都会产生Ag2SO4沉淀
D.若使用0.01 mol/LAgNO3溶液,可基本排除SO42-对Cl-检验构成的干扰
(3)将实验一中编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下实验。
实验二:
编号 | AgNO3溶液 浓度/(mol·L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
对于Ag2SO4溶于硝酸的原因提出了如下假设,请完成假设一。(已知:H2SO4=H++HSO4-、HSO4-![]() H++SO42-;假设二可能的原因是NO3-与Ag+形成配位化合物)
H++SO42-;假设二可能的原因是NO3-与Ag+形成配位化合物)
假设一:_____________。
假设二:NO3-对Ag2SO4溶解起作用。
(4)从下列限选试剂中选择适当试剂并设计实验方案,分别验证假设一和假设二是否成立。请写出实验步骤和结论。(限选试剂:Ag2SO4固体、浓HNO3、NaNO3饱和溶液、CaSO4固体)
________________
(5)通过(4)的实验,若证实假设一成立,请用平衡理论解释Ag2SO4溶解的原因_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C===O | O===O | C—C |
键能/(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g) ΔH1=________。
CH3CHO(g)+H2O(g) ΔH1=________。
②若反应2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)可自发进行,则CH3CH2OH(g)+O2(g)
2CH3COOH(g)可自发进行,则CH3CH2OH(g)+O2(g)![]() CH3COOH(g)+H2O(g) ΔH2________(填“>”“<”或“=”)0。
CH3COOH(g)+H2O(g) ΔH2________(填“>”“<”或“=”)0。
(2)将一定量的CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)![]() 2CH3CHO(g)+2H2O(g)至平衡状态。下列图象不合理的是________(填字母)。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图象不合理的是________(填字母)。
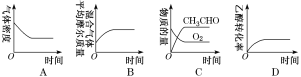
(3)已知:25 ℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.75×10-5,![]() ≈1.3,lg 1.3≈0.1。
≈1.3,lg 1.3≈0.1。
①25 ℃,0.1 mol·L-1CH3COOH溶液的pH=______;将0.1 mol·L-1CH3COOH溶液与0.1 mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为_______________________________。
②25 ℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=________。(保留2位有效数字)
③25 ℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O![]() NH4++OH-的电离平衡________(填“正向”“逆向”或“不”)移动;请用氨水和某种铵盐(其他试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质____________________________________。
NH4++OH-的电离平衡________(填“正向”“逆向”或“不”)移动;请用氨水和某种铵盐(其他试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com