
【题目】二碳化学的研究在工业生产中具有重要意义。
(1)在一定温度和压强下,已知:
化学键 | C—H | C—O | O—H | C===O | O===O | C—C |
键能/(kJ·mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
①CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g) ΔH1=________。
CH3CHO(g)+H2O(g) ΔH1=________。
②若反应2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)可自发进行,则CH3CH2OH(g)+O2(g)
2CH3COOH(g)可自发进行,则CH3CH2OH(g)+O2(g)![]() CH3COOH(g)+H2O(g) ΔH2________(填“>”“<”或“=”)0。
CH3COOH(g)+H2O(g) ΔH2________(填“>”“<”或“=”)0。
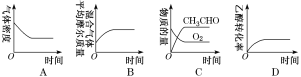
(2)将一定量的CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)![]() 2CH3CHO(g)+2H2O(g)至平衡状态。下列图象不合理的是________(填字母)。
2CH3CHO(g)+2H2O(g)至平衡状态。下列图象不合理的是________(填字母)。
(3)已知:25 ℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.75×10-5,![]() ≈1.3,lg 1.3≈0.1。
≈1.3,lg 1.3≈0.1。
①25 ℃,0.1 mol·L-1CH3COOH溶液的pH=______;将0.1 mol·L-1CH3COOH溶液与0.1 mol·L-1的氨水等体积混合,所得溶液中离子浓度大小关系为_______________________________。
②25 ℃,0.2 mol·L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=________。(保留2位有效数字)
③25 ℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,NH3·H2O![]() NH4++OH-的电离平衡________(填“正向”“逆向”或“不”)移动;请用氨水和某种铵盐(其他试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质____________________________________。
NH4++OH-的电离平衡________(填“正向”“逆向”或“不”)移动;请用氨水和某种铵盐(其他试剂与用品自选),设计一个实验证明NH3·H2O是弱电解质____________________________________。
【答案】-203 kJ·mol-1 < B 2.9 c(CH3COO-)=c(NH4+)>c(H+)=c(OH-) 5.7×10-10 逆向 取少量氨水于试管中,滴加2~3滴酚酞溶液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,证明NH3·H2O是弱电解质(或其他合理答案)
【解析】
(1)①根据反应的焓变等于反应物的键能和减去生成物的键能和进行计算;
②根据△G=△H2-T△S<0进行分析;
(2)根据图像进行分析;
(3)根据Ka(CH3COOH)计算溶液的pH值,等浓度等体积的CH3COOH溶液和的氨水混合恰好生成CH3COONH4,结合电荷守恒式得出结果;
(4)向0.1 mol·L-1氨水中加入少量NH4Cl固体,溶液中NH4+浓度增大,NH3·H2O![]() NH4++OH-的电离平衡逆向移动;欲证明NH3·H2O是弱电解质,可取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,即可证明NH3·H2O是弱电解质。
NH4++OH-的电离平衡逆向移动;欲证明NH3·H2O是弱电解质,可取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,即可证明NH3·H2O是弱电解质。
(1)①根据反应的焓变等于反应物的键能和减去生成物的键能和可知:CH3CH2OH(g)+1/2O2(g)![]() CH3CHO(g)+H2O(g) △H1=(414×5+332+464+326+498×1/2)kJ·mol-1-(414×4+332+728+464×2)kJ·mol-1=-203kJ·mol-1,故答案为:-203kJ·mol-1。
CH3CHO(g)+H2O(g) △H1=(414×5+332+464+326+498×1/2)kJ·mol-1-(414×4+332+728+464×2)kJ·mol-1=-203kJ·mol-1,故答案为:-203kJ·mol-1。
②已知2CH3CHO(g)+O2(g)![]() 2CH3COOH(g)的△S<0,若2CH3CHO(g)+O2(g)
2CH3COOH(g)的△S<0,若2CH3CHO(g)+O2(g) ![]() 2CH3COOH(g)反应可自发进行,则△G=△H2-T△S<0,故△H2<0;
2CH3COOH(g)反应可自发进行,则△G=△H2-T△S<0,故△H2<0;
故答案为:<。
(2)
A.气体的总质量不变,混合气体的体积增大,则密度先减小后不变,故A正确;
B.气体的总质量不变,混合气体的总物质的最变大,平衡摩尔质量逐渐变小,最终不变,故B错误;
C.随反应的进行,反应物的量逐渐减小,生成物的量逐渐增大,最终不变,故C正确;
D.反应物的转化率未平衡前增大,平衡后不变,故D正确。
故答案为:B。
(3)①已知CH3COOH![]() CH3COO-+H+,25℃,0.lmol·L-1CH3COOH溶液中Ka(CH3COOH)=[c(H+)×c(CH3COO-)]÷c(CH3COOH)=1.75×10-5,则c(H+)2=1.75×10-5÷c(CH3COOH)=1.75×10-5÷0.1mol/L=1.75×10-6,c(H+)=
CH3COO-+H+,25℃,0.lmol·L-1CH3COOH溶液中Ka(CH3COOH)=[c(H+)×c(CH3COO-)]÷c(CH3COOH)=1.75×10-5,则c(H+)2=1.75×10-5÷c(CH3COOH)=1.75×10-5÷0.1mol/L=1.75×10-6,c(H+)=![]() ×10-3mol/L=1.3×10-3mol/L,此时溶液的pH=3-lg1.3=2.9;
×10-3mol/L=1.3×10-3mol/L,此时溶液的pH=3-lg1.3=2.9;
CH3COOH的电离能力和NH3·H2O相同,则CH3COO-和NH4+水解能力也相同,则CH3COONH4溶液显中性,等浓度等体积的CH3COOH溶液和的氨水混合恰好生成CH3COONH4,结合电荷守恒式c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),所得溶液中离子浓度大小关系为c(CH3COO-)=c(NH4+)>c(H+)=c(OH-);
故答案为:2.9,c(CH3COO-)=c(NH4+)>c(H+)=c(OH-)。
②已知NH4++H2O![]() NH3·H2O+H+,此时Kh=Kw÷Kb(NH3·H2O)=1×10-14÷1.75×10-5=5.7×10-10,
NH3·H2O+H+,此时Kh=Kw÷Kb(NH3·H2O)=1×10-14÷1.75×10-5=5.7×10-10,
故答案为:5.7×10
③25℃,向0.1 mol·L-1氨水中加入少量NH4Cl固体,溶液中NH4+浓度增大,NH3·H2O![]() NH4++OH-的电离平衡逆向移动;欲证明NH3·H2O是弱电解质,可取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,即可证明NH3·H2O是弱电解质,故答案为:逆向;取少量氨水于试管中,滴加2~3滴酚酞溶液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,证明NH3·H2O是弱电解质(或其他合理答案)。
NH4++OH-的电离平衡逆向移动;欲证明NH3·H2O是弱电解质,可取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,即可证明NH3·H2O是弱电解质,故答案为:逆向;取少量氨水于试管中,滴加2~3滴酚酞溶液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅,证明NH3·H2O是弱电解质(或其他合理答案)。


科目:高中化学 来源: 题型:
【题目】按要求填空
(1)为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液 ![]()
![]() 粗盐
粗盐
第①步的操作是________,第⑤步的操作是________, 第⑦步置于________(填仪器的名称)中进行。
(2)4.5g水与_____g磷酸(H3PO4)所含的分子数相等,它们所含的氧原子数之比是_______。
(3)质量都是50g 的Cl2、NH3、CO2、O2 四种气体中,含有分子数最少的是________;在相同的温度和压强下,体积最大的是________。
(4)今有0.1mol/L NaCl溶液300mL,0.1mol/L MgCl2溶液200mL和0.1mol/LAlCl3溶液100mL,这三种溶液中氯离子浓度之比是_______________。
(5)实验室需要配制480mL 1mol/L H2SO4溶液,需要质量分数为98%,密度为1.84g/cm3的浓H2SO4________mL(保留一位小数),配制时用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有两种仪器分别是________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应:FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中的一个重要反应,其温度与平衡常数K的关系如下表:
T(K) | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量______;充入氦气,混合气体的密度____(填“增大”“减小”或“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列五种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①用等式表示Na2CO3溶液中含有H+ 、OH- 、HCO3-、H2CO3微粒间的关系_________。
②根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最强的是________;将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH
③要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应:2A(g) + B(g) = 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
A.用物质A表示的反应速率为0.3mol/(L·s)
B.用物质B表示的反应速率为0.3mol/(L·s)
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如图所示:

容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的小
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06molN2和0.12 molCO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化氨基汞[Hg(NH2)Cl]是祛斑霜中常用的添加剂,可由反应:Hg+2NH3+Cl2==Hg(NH2)Cl↓+NH4Cl制备,某学习小组在实验室中利用下列装置制备氯化氨基汞,回答下列问题。
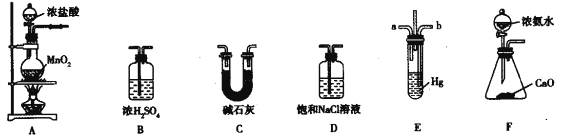
(1)A中发生反应的离子方程式为____________。
(2)F中发生反应的化学方程式为_________。
(3)盛装碱石灰的仪器名称为________,其作用为__________。
(4)整个装置的仪器连接顺序为A→________(装置不能重复使用)。该实验的不足之处是__________。
(5)E中短导管a通入的气体是__________,导管ab采用长短不同的原因是__________。
(6)氯化氨基汞产品中氯化氨基汞的含量测定:称取ag样品,加入水及稀硫酸溶解向溶解后的溶液中加入0.1mol/L KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知Hg2++2I—=HgI2↓(橙红色),HgI2+2I—=HgI42—(无色)],共消耗V mL KI溶液。测定产品中氯化氨基汞的质量分数为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的短周期元素,且X、Z原子序数之和是Y、W原子序数之和的1/2。甲、乙、丙、丁是由这些元素组成的二元化合物,M是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物N是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 原子半径:r(Y)>r(Z)>r(W)
B. 化合物N与乙烯均能使溴水褪色,且原理相同
C. 含W元素的盐溶液可能显酸性、中性或碱性
D. Z与X、Y、W形成的化合物中,各元素均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA
B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA
C. 生成1mol还原产物时转移电子数为8NA
D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗痫灵(G)具有抗癫痫、抗惊厥、抗抑郁等功效,其合成路线如下图所示(某些反应条件和副产物已略):

(1)A中含氧官能团名称是______;简述证明A含有该官能团的实验方法:_________。
(2)若以醛基为母体,则B的系统命名法的名称为_______;①~⑥的反应中属于加成反应的是____ (填序号)。
(3)芳香化合物H是C的同分异构体,H的相关信息如下:
a.可发生银镜反应; b.可与NaHCO3溶液反应生成气体;c.苯环上的一溴代物有2种,则H的结构简式为__________。
(4)写出反应⑥的化学反应方程式:_____________。
(5)( )的单体是薰衣草的调和香料,以苯甲醛(
)的单体是薰衣草的调和香料,以苯甲醛(![]() )为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)
)为起始原料(其余有机、无机原料任选),参照G的合成,设计并补充完成下列合成路线图:__________(空格内有几步,写几步。)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com