
【题目】人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2]。下列有关说法正确的是( )
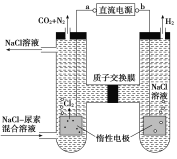
A. a为电源的负极
B. 电解结束后,阴极室溶液的pH与电解前相比将升高
C. 除去尿素的反应为:CO(NH2)2+2Cl2+H2O== N2+CO2+4HCl
D. 若两极共收集到气体0.6mol,则除去的尿素为0.12mol(忽略气体溶解,假设氯气全部参与反应)
【答案】D
【解析】
A、由图可以知道,左室电极产物为CO2和N2,发生氧化反应,故a为电源的正极,右室电解产物H2,发生还原反应,故b为电源的负极,故A错误;
B、阴极反应为6H2O+6e-=6OH-+3H2↑,阳极反应为6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+,通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变,故B错误;
C、由图可以知道,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,故C错误;
D、如图所示,阴极反应为6H2O+6e-=6OH-+3H2↑,阳极反应为6Cl--6e-=3Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl,若两极共收集到气体0.6mol,则n(N2)=n(CO2)=0.6×1/5mol=0.12mol,由反应CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl可知所消耗的CO(NH2)2的物质的量也为0.12mol,故D正确。答案选D。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】在某一容积为5 L的密闭容器内,加入0.2 mol的CO和0.2 mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应中CO2的浓度随时间变化情况如图:
CO2(g)+H2(g),反应中CO2的浓度随时间变化情况如图:

(1)根据图中数据,反应开始至达到平衡时,CO的化学反应速率为_______,反应达平衡时,c(H2)=______。
(2)判断该反应达到平衡的依据是______(填序号)。
①CO减少的速率和CO2减少的速率相等
②CO、H2O、CO2、H2的浓度都相等
③CO、H2O、CO2、H2的浓度都不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 1 molN2与4molH2混合充分反应,则转移的电子数目为6mol
B. 向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中![]() 减小
减小
C. 常温下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
D. HCl和NaOH反应的中和热为-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热为-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中的氮氧化物是造成大气污染的重要因素。
(1)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
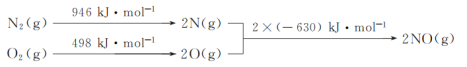
则N2(g)和O2(g)反应生成NO(g)的热化学反应方程式为___。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag—ZSM—5为催化剂,测得NO转化为N2的转化率随温度变化情况如图1所示。
①若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为_____。
②NO直接催化分解(生成N2与O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如图2所示。请写出NO分解的化学方程式:______。

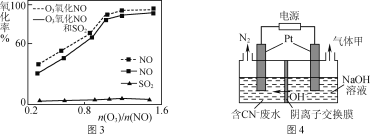
(3)一定条件下,向NOx/O3混合物中加入一定浓度的SO2气体,进行同时脱硫脱硝实验,实验结果如图3。
①同时脱硫脱硝时NO的氧化率略低的原因是____。
②由图3可知SO2对NO的氧化率影响很小的原因是_____。
(4)有人设想采用下列方法减少烟气中的氮氧化物对环境的污染:用天然气中的CH4、H2等还原SO2,从产物中分离出一种含硫质量分数约为94%的化合物,并用这种化合物来还原NOx。请写出这种含硫化合物和NOx反应的化学方程式:_____。
(5)某工业废水中含有毒性较大的CN-,可用电解法将其转变为N2,装置如图4所示。电解池中生成N2的电极反应式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组模拟工业上从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的工艺流程如下:(已知溶液D中通入过量的CO2得到白色沉淀)

请回答下列问题:
(1)操作Ⅰ的名称为________。
(2)不溶物A是_________________(填化学式),写出A与氢氧化钠溶液反应的离子方程式_________________________________。
(3)+3价的铝常或多或少地置换硅酸盐中+4价的硅而形成铝硅酸盐。已知某种铝硅酸盐主要成分的化学式为Al2Si2O5(OH)4,请将其改写成氧化物的组合形式________。
(4)溶液D中Al元素的主要存在形式为_____________(填离子符号)
(5)写出E→G的化学方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:A(g)![]() 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1,容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
时间t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)下列能提高A的转化率的是____。
A 升高温度 B 体系中通入A气体
C 将D的浓度减小 D 通入稀有气体He,使体系压强增大到原来的5倍
E 若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数表达式K=___;前2小时C的反应速率是____;计算平衡时A的转化率_____。
(3)若将容器改为恒压容器,改变条件,使反应达到与上述相同的转化率,则达到平衡时B浓度为____。(保留两位有效数字)
Ⅱ.锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正极材料。请回答下列问题:
(4)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:Li3N+2H2![]() LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的____%(精确到0.1%)。
LiNH2+2LiH,在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的____%(精确到0.1%)。
(5)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出该反应的化学方程式______。
(6)磷酸亚铁锂电池稳定性高、安全、对环境友好,该电池在充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LiXC6-xe- =xLi++6C,写出电池放电时的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐![]()
![]()
![]()
![]()
![]() 滤液
滤液 ![]()
![]() 粗盐
粗盐
第①步的操作是________,第⑤步的操作是________, 第⑦步置于________(填仪器的名称)中进行。
(2)4.5g水与_____g磷酸(H3PO4)所含的分子数相等,它们所含的氧原子数之比是_______。
(3)质量都是50g 的Cl2、NH3、CO2、O2 四种气体中,含有分子数最少的是________;在相同的温度和压强下,体积最大的是________。
(4)今有0.1mol/L NaCl溶液300mL,0.1mol/L MgCl2溶液200mL和0.1mol/LAlCl3溶液100mL,这三种溶液中氯离子浓度之比是_______________。
(5)实验室需要配制480mL 1mol/L H2SO4溶液,需要质量分数为98%,密度为1.84g/cm3的浓H2SO4________mL(保留一位小数),配制时用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有两种仪器分别是________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的NaCl、MgCl2、AlCl3溶液,要使氯离子完全沉淀,消耗同浓度同体积的硝酸银溶液,则上述三种溶液的物质的量浓度之比为
A.1:2:3B.3:2:1C.2:3:6D.6:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体置于2L的密闭容器中,混合后发生如下反应:2A(g) + B(g) = 2C (g) 。若经2s后测得C的浓度为 0.6mol/L ,下列说法正确的是
A.用物质A表示的反应速率为0.3mol/(L·s)
B.用物质B表示的反应速率为0.3mol/(L·s)
C.2s时物质A的转化率为30%
D.2s时物质B的浓度为0.3mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com