
 如图每一方框中的字母代表一种反应物或生成物.产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,H在常温下是臭鸡蛋气味的气体,C在空气中燃烧生成淡黄色固体,D是淡黄色固体单质.试填写下列空白:
如图每一方框中的字母代表一种反应物或生成物.产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,H在常温下是臭鸡蛋气味的气体,C在空气中燃烧生成淡黄色固体,D是淡黄色固体单质.试填写下列空白:
| ||
| ||


科目:高中化学 来源: 题型:
| A、密度:1-溴甲烷<1-溴乙烷<1-溴丙烷 |
| B、等物质的量的醇与足量Na反应生成氢气的量:甲醇<乙二醇<丙三醇 |
| C、沸点:邻二甲苯>间二甲苯>对二甲苯 |
| D、在水中溶解性:乙醇>正丁醇>正十二醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
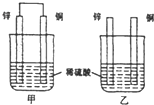 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
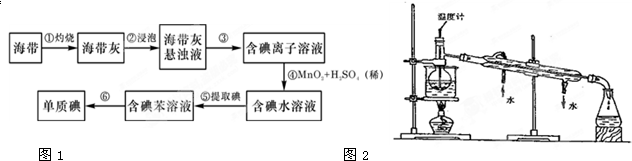
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com