

| ||


科目:高中化学 来源: 题型:
| A、②③⑤ | B、②④ |
| C、③④⑤ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO+H2O═Ca(OH)2 | ||||
B、C+H2O
| ||||
| C、HCl+NaOH═NaCl+H2O | ||||
| D、2Al+3H2SO4═Al2(SO4)3+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
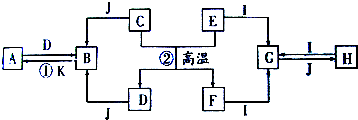
 如图每一方框中的字母代表一种反应物或生成物.产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,H在常温下是臭鸡蛋气味的气体,C在空气中燃烧生成淡黄色固体,D是淡黄色固体单质.试填写下列空白:
如图每一方框中的字母代表一种反应物或生成物.产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,H在常温下是臭鸡蛋气味的气体,C在空气中燃烧生成淡黄色固体,D是淡黄色固体单质.试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| T(℃) | 200 | 600 | 800 |
| ρ(g/L) | 6.881 | 2.650 | 1.517 |
| 气体摩尔体积(L/mol) | 38.8 | 71.6 | 88.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com