
【题目】实验室常利用难挥发性酸制备易挥发性酸的原理,用浓硫酸与硝石(NaNO3)反应制备HNO3,反应装置如图,下列说法不正确的是
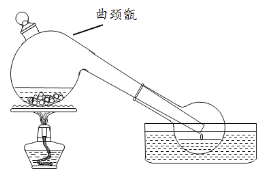
A.反应温度如果过高,制得HNO3可能会呈现黄色
B.反应方程式为:NaNO3 + H2SO4(浓)![]() NaHSO4 + HNO3↑
NaHSO4 + HNO3↑
C.可从实验室中选无色透明洁净的试剂瓶盛装制得的硝酸
D.曲颈甑不适宜制备沸点过低的物质
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.NaHCO3的水解方程式:![]() +H2O
+H2O![]() H3O++
H3O++![]()
B.Fe2O3与HI充分反应:Fe2O3+6H+=2Fe3++3H2O
C.铜插入稀硝酸中:Cu+4H++2![]() =Cu2++2NO↑+H2O
=Cu2++2NO↑+H2O
D.NaClO溶液中通入少量的CO2:ClO-+CO2+H2O=HClO+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸为弱酸。25℃时将0.1mol·L-1的HF加水不断稀释,下列表示的量保持不变的是( )
①n(H+);②c(H+)·c(OH—);③c(OH—)+c(F—);④![]() ;⑤
;⑤![]() ;
;
A.①③④B.②③④C.③④⑤D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.不是所有的共价键都具有方向性
B.N≡N键能大于C≡C的键能,所以N≡N不易发生加成反应
C.根据价层电子对互斥理论可知,OF2分子的构型和H2O分子的构型相同
D.Na原子基态核外电子占有3个能层,4种能级,6个原子轨道,有6种电子运动状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平两盘上分别放有盛有等质量的足量稀盐酸的烧杯,调整天平至平衡。向左边烧杯中加入10.8 g镁条,向右边烧杯中加入10.8 g铝条(两金属外形相同,表面均经过砂纸打磨处理)。反应过程中指针偏转情况正确的是( )
A.先偏左,最后偏右B.先偏右,最后偏左
C.先偏左,最后平衡D.先偏右,最后平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近代化学工业的基础是“三酸两碱”,早在我国古代就已经有人通过煅烧绿矾并将产生的气体溶于水中的方法制得硫酸,该法制备硫酸的过程中发生的主要反应如下:
反应Ⅰ:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑;
Fe2O3+SO2↑+SO3↑+14H2O↑;
反应Ⅱ:SO3+H2O=H2SO4。
下列说法不正确的是( )
A.当生成标准状况下气体22.4L时,转移1mol电子
B.6.4gSO2中所含的质子数与6.4gSO3中所含的质子数相等
C.SO2、SO3的中心原子杂化类型不同
D.目前,工业上制硫酸的吸收阶段是采用浓硫酸吸收SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保险粉(Na2S2O4)可用作食品保鲜剂、纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇。在碱性介质中较稳定,在空气中易被氧化。锌粉法制备Na2S2O4的工艺流程如图所示:

回答下列问题:
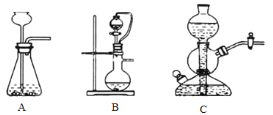
(1)实验室可用浓硫酸和亚硫酸钠反应制取SO2,并希望能控制反应速度,图中可选用的发生装置是________(填字母)。
(2)工业上常将锌块进行预处理得到锌粉—水悬浊液,其目的是_________;步骤Ⅰ中发生反应的化学方程式为__________。
(3)步骤Ⅱ中需选用的玻璃仪器除了烧杯、玻璃棒之外,还有__________(填名称)。
(4)在步骤III中加入NaCl的作用是_______,得到的Na2S2O4固体要用乙醇洗涤,其优点是_________。
(5)铁氰化钾可用于分析检测保险粉。铁氰化钾K3[Fe(CN)6]是一种比较弱的氧化剂,其具有强氧化剂所没有的选择性氧化性,能将![]() 氧化为
氧化为![]() ,[Fe(CN)6]3还原为[Fe(CN)6]4,该反应的离子方程式为___________;取1.16g Na2S2O4样品溶于水,用0.4mol·L1的K3[Fe(CN)6]标准液滴定至终点,消耗25.00mL。该样品中Na2S2O4的质量分数为________。
,[Fe(CN)6]3还原为[Fe(CN)6]4,该反应的离子方程式为___________;取1.16g Na2S2O4样品溶于水,用0.4mol·L1的K3[Fe(CN)6]标准液滴定至终点,消耗25.00mL。该样品中Na2S2O4的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | 位于第ⅠB族,其被称作“电器工业的主角” |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是____,M2+的核外电子排布式为_______。
(2)M2Z的熔点比M2W的______(填“高”或“低”),请解释原因:_____________。
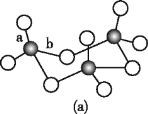
(3)WZ2的VSEPR模型名称为______;WZ3气态为单分子,该分子中W原子的杂化轨道类型为____;WZ3的三聚体环状结构如图(a)所示,该结构的分子中含有____个σ键;写出一种与WZ3互为等电子体的分子的化学式_____。
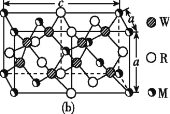
(4)MRW2的晶胞如图(b)所示,晶胞参数a=0.524 nm、c=1.032 nm;MRW2的晶胞中,晶体密度ρ=____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023 mol-1)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com