
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | 位于第ⅠB族,其被称作“电器工业的主角” |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是____,M2+的核外电子排布式为_______。
(2)M2Z的熔点比M2W的______(填“高”或“低”),请解释原因:_____________。
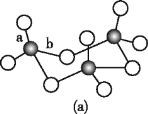
(3)WZ2的VSEPR模型名称为______;WZ3气态为单分子,该分子中W原子的杂化轨道类型为____;WZ3的三聚体环状结构如图(a)所示,该结构的分子中含有____个σ键;写出一种与WZ3互为等电子体的分子的化学式_____。
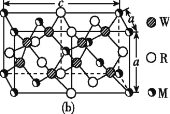
(4)MRW2的晶胞如图(b)所示,晶胞参数a=0.524 nm、c=1.032 nm;MRW2的晶胞中,晶体密度ρ=____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023 mol-1)。
【答案】O [Ar]3d9或1s22s22p63s23p63d9 高 氧离子半径比硫离子半径小,Cu2O比Cu2S的晶格能大,所以Cu2O熔点高 平面三角形 sp2 12 BF3等 ![]()
【解析】
Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大。Y的原子核外有6个不同运动状态的电子,Y为C元素; Z是非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同,Z的电子排布式为1s2s22p4,Z为O元素;W是主族元素,与Z原子的价电子数相同,W为S元素;R的价层电子排布式为3d64s2, R为Fe元素;M位于第IB族,其被称作“电器工业的主角”,为Cu元素,据此分析结合元素性质解答。
(1) Z为O元素,W为S元素,同一主族,从上到下,第一电离能逐渐减小,O和S元素相比,第一电离能较大的是O,M为Cu元素,Cu2+的核外电子排布式为[Ar]3d9或1s22s22p63s23p63d9;
(2) M为Cu元素,Z为O元素,W为S元素,M2Z为Cu2O,M2W为Cu2S,由于氧离子的半径小于硫离子的半径,则Cu2O比Cu2S的晶格能大,所以Cu2O的熔点比Cu2S的高;
(3) W为S元素,Z为O元素,WZ2为SO2,中心原子S价层电子对数=2+![]() =3,S原子采取sp2杂化,VSEPR模型名称为平面三角形;SO3气态为单分子,该分子中S原子的价层电子对数=3+
=3,S原子采取sp2杂化,VSEPR模型名称为平面三角形;SO3气态为单分子,该分子中S原子的价层电子对数=3+![]() =3,杂化轨道类型为sp2;单键都为σ键,SO3的三聚体环状结构如图(a)所示,该结构的分子中含有12个σ键,SO3由4个原子构成,价电子总数为24,与SO3互为等电子体的分子的化学式为BF3;
=3,杂化轨道类型为sp2;单键都为σ键,SO3的三聚体环状结构如图(a)所示,该结构的分子中含有12个σ键,SO3由4个原子构成,价电子总数为24,与SO3互为等电子体的分子的化学式为BF3;
(4)MRW2为CuFeS2,晶胞中每个Cu原子与4个S原子相连,CuFeS2的晶胞中S原子个数=8、Fe原子个数=4×![]() +4×
+4×![]() +2×
+2×![]() =4、Cu原子个数=8×
=4、Cu原子个数=8×![]() +4×
+4×![]() +1=4,晶胞体积=a2c=(0.524×10-7×0.524×10-7×1.032×10-7)cm3,晶体密度ρ=
+1=4,晶胞体积=a2c=(0.524×10-7×0.524×10-7×1.032×10-7)cm3,晶体密度ρ=![]() =
=![]() =
=![]() g/cm3=
g/cm3=![]() g/cm3。
g/cm3。


 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室常利用难挥发性酸制备易挥发性酸的原理,用浓硫酸与硝石(NaNO3)反应制备HNO3,反应装置如图,下列说法不正确的是
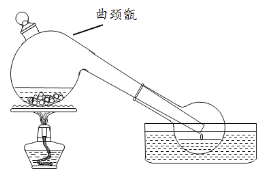
A.反应温度如果过高,制得HNO3可能会呈现黄色
B.反应方程式为:NaNO3 + H2SO4(浓)![]() NaHSO4 + HNO3↑
NaHSO4 + HNO3↑
C.可从实验室中选无色透明洁净的试剂瓶盛装制得的硝酸
D.曲颈甑不适宜制备沸点过低的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)bM(g)(a≠b),M、N的物质的量随时间的变化曲线如图所示:
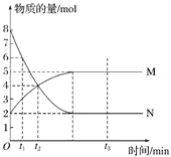
下列叙述中能说明上述反应达到平衡状态的是___。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某三元羧酸 H3A 在表面活性剂、洗涤剂、润滑剂等方面具有重要的地位。常温时,向 10 mL 0.01 mol·L1 的 H3A 溶液中滴入 0.01 mol·L1 的 NaOH 溶液,H3A、H2A、HA2、A3的物质的量分数与溶液的 pH 的关系如 图所示。下列说法错误的是( )
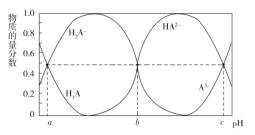
A.该温度下,H3A 的电离常数 Ka1=10a
B.若 b=7,加入 20 mL NaOH 溶液时,溶液的 pH<7
C.NaOH 溶液的体积为 30 mL 时,溶液中:c(OH)=3c(H3A)+2c(H2A)+c(HA2)+c(H+)
D.反应 2H2A![]() H3A+HA2在该温度下的平衡常数K=10a-b
H3A+HA2在该温度下的平衡常数K=10a-b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:2A(g)+B(g)![]() 2C(g)。在一定条件下,将A、B、C三种气体各1mol通入密闭容器中发生反应,达到平衡时,物质B的物质的量可能是( )
2C(g)。在一定条件下,将A、B、C三种气体各1mol通入密闭容器中发生反应,达到平衡时,物质B的物质的量可能是( )
A.0
B.0.5mol
C.0.8mol
D.1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年由英国化学家汉弗莱·戴维发现一氧化二氮(N2O)气体具有轻微的麻醉作用,而且对心脏、肺等器官无伤害,后被广泛应用于医学手术中。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为 ___。
(2)已知反应2N2O(g)=2N2(g)+O2(g)的ΔH=–163kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945kJ、498kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为______kJ。
在的一能定量温为度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
![]()
①在0~20min时段,反应速率v(N2O)为 ___mol·L-1·min-1。
②若N2O起始浓度c0为0.150mol/L ,则反应至30min时N2O的转化率α=___。
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1 ___T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p= ___(用p0表示)。

(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) = 2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时NO分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是___(填标号)。
A.温度升高,k值增大 B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机化合物,A是分子式为C5H10O的直链化合物,B与NaHCO3溶液完全反应,其物质的量之比为1∶2,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基)。下列叙述正确的是( )
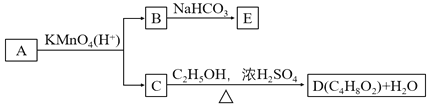
A.B的结构简式为HOOCCH2CH2OHB.D有6种同分异构体
C.A可以与氢氧化钠溶液发生中和反应D.E的分子式为C3H2O4Na2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com