
【题目】已知可逆反应:2A(g)+B(g)![]() 2C(g)。在一定条件下,将A、B、C三种气体各1mol通入密闭容器中发生反应,达到平衡时,物质B的物质的量可能是( )
2C(g)。在一定条件下,将A、B、C三种气体各1mol通入密闭容器中发生反应,达到平衡时,物质B的物质的量可能是( )
A.0
B.0.5mol
C.0.8mol
D.1.5mol
【答案】C
【解析】
将A、B、C三种物质各1mol通入一个密闭容器中发生反应:2A+B2C,假设平衡向正反应方向移动且A完全转化为生成物,此时A和B的物质的量最少、C的物质的量最多,如果平衡向逆反应方向移动且C完全转化为A和B,此时A和B的物质的量最多、C的物质的量最少,据此分析解答。
将A. B.C三种物质各1mol通入一个密闭容器中发生反应:2A+B2C,假设平衡向正反应方向移动且A完全转化为生成物,此时A和B的物质的量最少、C的物质的量最多,则n(A)=0、n(B)=1mol0.5mol=0.5mol、n(C)=1mol+1mol=2mol;
如果平衡向逆反应方向移动且C完全转化为A和B,此时A和B的物质的量最多、C的物质的量最少,n(C)=0、n(B)=0.5mol+1mol=1.5mol、n(A)=1mol+1mol=2mol,所以最终平衡状态时n(A)在02mol之间、n(B)在0.5mol1.5mol之间、n(C)在02mol之间,
答案选C。


科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一些常见含氯产品,根据情况回答下列问题。

(1)下列有关氯单质和氯水的说法正确的是________(填序号)。
①液氯是纯净物,氯水是混合物
②氯气可使湿润的红色布条褪色,所以氯气具有漂白性
③过量的铁在少量的氯气中燃烧生成FeCl2
④新制氯水可使蓝色石蕊试纸先变红后褪色
⑤新制氯水放置数天后酸性将减弱
(2)用化学方程式表示漂白粉的漂白原理________________________ ;
(3)向FeSO4溶液中滴加氯水,溶液变为黄色,写出反应的离子方程式_____
(4)据报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分为稀盐酸)与“84”消毒液(有效成分NaClO),而发生氯气中毒事件,请从氧化还原的角度分析原因________________________(用离子方程式表示)。
(5)一定量铁粉与氯气充分反应后,加适量水,完全溶解后无固体剩余,此时所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等,则已反应的Fe3+和未反应的Fe3+的质量之比是________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是
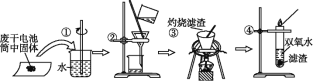
A. 操作①中玻璃棒的作用是转移固体 B. 操作②为过滤,得到的滤液显碱性
C. 操作③中盛放药品的仪器是坩埚 D. 操作④的目的是除去滤渣中的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | 位于第ⅠB族,其被称作“电器工业的主角” |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是____,M2+的核外电子排布式为_______。
(2)M2Z的熔点比M2W的______(填“高”或“低”),请解释原因:_____________。
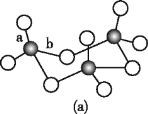
(3)WZ2的VSEPR模型名称为______;WZ3气态为单分子,该分子中W原子的杂化轨道类型为____;WZ3的三聚体环状结构如图(a)所示,该结构的分子中含有____个σ键;写出一种与WZ3互为等电子体的分子的化学式_____。
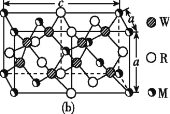
(4)MRW2的晶胞如图(b)所示,晶胞参数a=0.524 nm、c=1.032 nm;MRW2的晶胞中,晶体密度ρ=____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023 mol-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界某著名学术刊物介绍了一种新型中温全瓷铁空气电池,其结构如图所示。

下列有关该电池放电时的说法正确的是( )
A.a极发生氧化反应
B.正极的电极反应式为FeOx+2xe-=Fe+xO2-
C.若有22.4 L(标准状况)空气参与反应,则电路中有4 mol电子转移
D.铁表面发生的反应为xH2O(g)+Fe=FeOx+xH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中A为电流表。请回答下列问题:
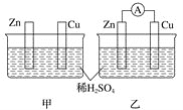
(1)以下叙述中,正确的是_______________(填字母)。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液pH均增大
D.产生气泡的速度甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
F.乙溶液中![]() 向铜片方向移动
向铜片方向移动
(2)变化过程中能量转化的主要形式:甲为___________;乙为______。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是___。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式及总反应离子方程式:铜电极:____,总反应:___。当电路中转移0.25 mol电子时,消耗负极材料的质量为_____g(Zn的相对原子质量65)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。利用“KClO3氧化法”制备KIO3工艺流程如图所示:

已知:酸化反应产物有KH(IO3)2、Cl2和KCl
(1)“酸化反应”所需I2从海带中提取。经历灼烧海带,浸泡海带灰等步骤,向获得的I-溶液加入MnO2,在酸性条件下生成I2,其离子反应方程式为___。
(2)酸化产物KH(IO3)2所含化学键有___,“调pH”中发生反应的化学方程式为___。
(3)已知KIO3在水中随温度升高而增大,则浓缩结晶的具体步骤是___。
(4)KIO3也可采用“电解法”制备,装置如图所示。

①KOH与I2制备KIO3的离子反应方程式为___。
②电解时阳极的电极反应式:___;阴极的电极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某化学学习小组为探究NO2和SO2的反应,进行如下实验(如图所示)。
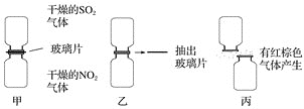
①图甲两集气瓶中________(填“上”或“下”)瓶颜色深。
②图乙中反应的现象是___________________________________________________。
③图丙中“有红棕色气体产生”说明SO2和NO2反应的产物中有____________,说明NO2在该反应中显____________性。
④由图乙和图丙中的现象写出NO2和SO2反应的化学方程式:________________________。
(2)某课外活动小组探究镁与NO2的反应。已知镁与CO2反应如下:2Mg+CO2![]() 2MgO+C
2MgO+C
①该小组采用类比Mg与CO2反应的思路对Mg与NO2的反应进行预测,写出Mg与NO2反应的化学方程式:______________________________________________________。
②设计实验验证猜测(用于连接玻璃管的乳胶管均内衬锡纸)
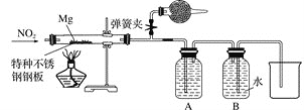
资料信息:2NO2+2NaOH===NaNO3+NaNO2+H2O
Ⅰ.装置A中的试剂是____________。
Ⅱ.干燥管和装置B的作用分别是________________________________________________、____________________。
Ⅲ.实验开始时正确的操作步骤是__________。
a.通入NO2
b.打开弹簧夹
c.点燃酒精灯
d.当硬质玻璃管充满红棕色气体后,关闭弹簧夹
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com