
【题目】如图是一些常见含氯产品,根据情况回答下列问题。

(1)下列有关氯单质和氯水的说法正确的是________(填序号)。
①液氯是纯净物,氯水是混合物
②氯气可使湿润的红色布条褪色,所以氯气具有漂白性
③过量的铁在少量的氯气中燃烧生成FeCl2
④新制氯水可使蓝色石蕊试纸先变红后褪色
⑤新制氯水放置数天后酸性将减弱
(2)用化学方程式表示漂白粉的漂白原理________________________ ;
(3)向FeSO4溶液中滴加氯水,溶液变为黄色,写出反应的离子方程式_____
(4)据报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分为稀盐酸)与“84”消毒液(有效成分NaClO),而发生氯气中毒事件,请从氧化还原的角度分析原因________________________(用离子方程式表示)。
(5)一定量铁粉与氯气充分反应后,加适量水,完全溶解后无固体剩余,此时所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等,则已反应的Fe3+和未反应的Fe3+的质量之比是________________________
【答案】①④ Ca(ClO)2+CO2+H2O=CaCO3+2HClO 2Fe2++Cl2=2Fe3++2Cl- Cl-+ClO-+2H+ = Cl2↑+H2O ![]() (或2:3)
(或2:3)
【解析】
(1)根据氯气和氯水的性质进行分析;
(2)石灰乳和氯气反应制备漂白粉;
(3)氯气具有氧化性,能够把亚铁离子氧化为铁离子;
(4)NaClO与HCl在酸性环境下发生氧化还原反应生成氯气;
(5)Fe与Cl2在点燃条件下生成FeCl3,将反应后的固体投于水中,Fe3+能与剩余的Fe反应生成FeCl2,反应的方程式:2Fe+3Cl2=2FeCl3,2Fe3++Fe=3Fe2+,据以上分析进行计算。
(1)①液氯为液态氯,为纯净物,氯水为氯气与水反应后的混合物,故①正确;
②氯气使湿润的红色布条褪色,其原因是氯气与水反应生成了具有漂白性的HClO,氯气本身不具有漂白性,故②错误;
③铁与氯气燃烧反应生成FeCl3,与反应物的量无关,故③错误;
④新制氯水中含有H+,能够使蓝色石蕊试纸变红,新制氯水中含有HClO,具有漂白性,能够使变红的试纸褪色,故④正确;
⑤新制氯水长期放置过程中,因HClO稳定性较差,见光或受热易发生分解生成HCl、O2,会使溶液的酸性增强,故⑤错误;
故答案为:①④;
(2)漂白粉的有效成分为Ca(ClO)2,其与空气中CO2反应生成具有漂白性的HClO,其反应方程式为:Ca(ClO)2+CO2+H2O=CaCO3 +2HClO;
故答案为:Ca(ClO)2+CO2+H2O=CaCO3 +2HClO;
(3)FeSO4中Fe2+具有还原性,氯水中Cl2具有氧化性,二者可发生反应生成黄色Fe3+,其反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)Cl-具有还原性,ClO-具有氧化性,二者可发生氧化还原反应,根据氧化还原反应化合价变化规律可知,二者发生归中反应生成Cl2,根据守恒关系配平反应离子方程式为:Cl-+ClO-+2H+ = Cl2↑+H2O;
故答案为:Cl-+ClO-+2H+ = Cl2↑+H2O;
(5)Fe与Cl2在点燃条件下生成FeCl3,将反应后的固体投于水中,Fe3+能与剩余的Fe反应生成FeCl2,设与Cl2反应的Fe的物质的量为xmol,与FeCl3反应的Fe的物质的量为ymol,则
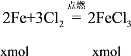
![]()
所得溶液中Fe2+和Fe3+的物质的量浓度恰好相等,则1.5y=x-y,可解得x=2.5y;
已反应的Fe3+的物质的量为ymol,未反应的Fe3+的物质的量为(x-y)mol=(2.5y-y)mol=1.5ymol,因此已反应的Fe3+和未反应的Fe3+的物质的量之比为![]() =
=![]() ,其质量之比等于其物质的量之比=
,其质量之比等于其物质的量之比=![]() ;
;
故答案为:![]() (或2:3)。
(或2:3)。


科目:高中化学 来源: 题型:
【题目】维生素C又称抗坏血酸,能增强对传染病的抵抗力,有解毒作用等,其结构式为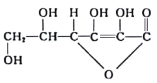 ,下列有关说法错误的是
,下列有关说法错误的是
A.维生素C分子式为C6H8O6
B.维生素C的同分异构体中可能有芳香族化合物
C.向维生素C溶液中滴加紫色石蕊试液,溶液颜色变红,说明维生素C溶液显酸性
D.在一定条件下,维生素C能发生氧化反应、加成反应、取代反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的HCl溶液,溶液的AG![]() 变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是
变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是

A. 若a=-8,则Kb(XOH)≈10-5
B. M点表示盐酸和XOH恰好完全反应
C. R点溶液中可能存在c(X+)+c(XOH)=c(Cl-)
D. M点到N点,水的电离程度先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】看图回答下列问题
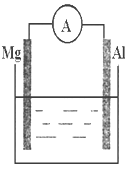
(1)若烧杯中溶液为稀硫酸,则观察到的现象是__________,电流表指针_______(填偏转或不偏转),两极反应式为:
正极_______________________;
负极________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为__________(填Mg或Al),总反应方程式为__________。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右下图所示:A、B两个电极均由多孔的碳块组成。
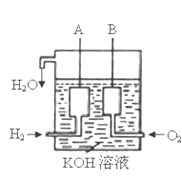
该电池的正极反应式为:_____________________。
(4)如果将上述装置中通入的H2改成CH4气体,也可以组成一个原电 池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 取硫酸催化淀粉水解的反应液,滴入少量新制 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B |
| 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满 | 红棕色变深 | 反应 |
D | 向 | 得到红褐色透明液体 | 得到 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为VL的密闭容器中进行反应:aN(g)bM(g)(a≠b),M、N的物质的量随时间的变化曲线如图所示:
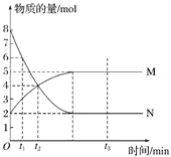
下列叙述中能说明上述反应达到平衡状态的是___。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗amolN,同时生成bmolM
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:2A(g)+B(g)![]() 2C(g)。在一定条件下,将A、B、C三种气体各1mol通入密闭容器中发生反应,达到平衡时,物质B的物质的量可能是( )
2C(g)。在一定条件下,将A、B、C三种气体各1mol通入密闭容器中发生反应,达到平衡时,物质B的物质的量可能是( )
A.0
B.0.5mol
C.0.8mol
D.1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化物是剧毒物质,传统生产工艺的电镀废水中含一定浓度的CN-,无害化排放时必须对这种废水进行处理。 可采用碱性条件下的Cl2氧化法处理这种废水,涉及两个反应:反应i,CN- +OH-+Cl2![]() OCN- +Cl-+H2O(未配平);
OCN- +Cl-+H2O(未配平);
反应ii,OCN- + OH-+ Cl2![]() X + Y + Cl-+ H2O(未配平)。
X + Y + Cl-+ H2O(未配平)。
其中反应i中N元素的化合价没有变化,常温下,X、Y是两种无毒的气体。下列判断正确的是( )
A.反应i中氧化剂与还原剂的化学计量数之比为1: 1
B.X、Y是CO2、N2,且均为反应ii的氧化产物
C.该废水处理工艺过程中须采取措施,防止Cl2逸出到空气中
D.处理c(CN-) =0.000 1 mol·L-1的废水106 L,消耗标况下的Cl2 4.48×103L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com