
【题目】有下列几个反应:①向NaAlO2溶液中滴加盐酸;②向盐酸和AlCl3的混合溶液中滴加NaOH溶液;③向NaOH溶液中滴加AlCl3溶液;
⑴符合反应①的图象是______,符合反应②的图象是_____,符合反应③的图象是____;

(2)写出③步骤中的二个离子方程式__________________、________________________。
【答案】D B C Al3++ 4OH-= AlO2-+ 2H2O Al3++ 3AlO2-+ 6H2O = 4Al(OH)3↓
【解析】
(1)①向NaAlO2溶液中逐滴加入盐酸至过量,偏铝酸钠先与盐酸反应生成氢氧化铝沉淀,然后氢氧化铝再与盐酸发生酸碱中和生成氯化铝,沉淀完全溶解;
②向含有盐酸的AlCl3溶液中滴加NaOH溶液,先是和盐酸发生中和反应,然后氢氧化钠和氯化铝反应产生沉淀,最后,沉淀完全消失;
③向NaOH溶液中滴加AlCl3溶液,开始没有沉淀,然后,偏铝酸钠和氯化铝生成沉淀;
(1)①向NaAlO2溶液中逐滴加入盐酸至过量,偏铝酸钠先与盐酸反应生成氢氧化铝沉淀,NaAlO2~HCl~Al(OH)3,然后氢氧化铝再与盐酸发生酸碱中和生成氯化铝,Al(OH)3~3HCl,沉淀完全溶解,产生最大量沉淀消耗盐酸的量和沉淀完全溶解消耗盐酸的量之比是1:3,故选D。
②向含有盐酸的AlCl3溶液中滴加NaOH溶液,先是和盐酸发生中和反应,HCl+NaOH=NaCl+H2O,然后氢氧化钠和氯化铝反应产生沉淀,AlCl3~3NaOH~Al(OH)3,最后,沉淀完全消失Al(OH)3~NaOH,B图象符合过程量的情况,故选B;
③向NaOH溶液中滴加AlCl3溶液,开始没有沉淀,然后,偏铝酸钠和氯化铝生成沉淀,C图象符合过程量的情况,故选C;
(2)向NaOH溶液中滴加AlCl3溶液,开始没有沉淀,离子方程式为:Al3++ 4OH-= AlO2-+ 2H2O,然后,偏铝酸钠和氯化铝生成沉淀离子方程式为:Al3++ 3AlO2-+ 6H2O = 4Al(OH)3↓。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应不能实砚如下图所示转化的是
选项 | X | Y | Z |
A | Na | NaOH | NaCl |
B | Si | SiO2 | Na2SiO3 |
C | Cl2 | HClO | NaClO |
D | NO | NO2 | HNO3 |
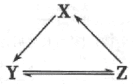
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢元素与其他元素形成的化合物称为氢化物,下列有关氢化物的叙述不正确的是
A. D2O分子的空间构型为直线形B. NH3的结构式为![]()
C. HCl分子中含有3个孤电子对D. H2S和H2O分子的中心原子都采用sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中26 Al和10 Be两种元素的比例来确定“北京人”的年龄,这种测量方法叫铝铍测年法。下列关于26 Al和10 Be的说法不正确的是( )
A.5.2g 26 Al3+中所含的电子数约为1.204×1024
B.10 Be和9 Be是中子数不同、质子数相同的不同原子
C.26 Al3+和26 Mg2+的质子数、中子数和核外电子数都不相同
D.10 Be原子核内的中子数比质子数多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO![]() 、NO
、NO![]() 等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
等在酸性条件下具有强氧化性,而S2-、I-、Fe2+等具有较强的还原性。下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A. Na+、Ba2+、Cl-、SO42— B. MnO4-、K+、I-、H+
C. Ca2+、HCO3—、Cl-、K+ D. H+、Cl-、Na+、CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是( )
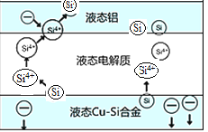
A.电子由液态Cu-Si合金流出,从液态铝电极流入
B.液态铝电极与负极相连,作为电解池的阴极
C.在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
D.三层液熔盐的作用是增大电解反应的面积,提高沉硅效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓度相等、体积均为100 mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,逐滴加入0.1 mol/L的盐酸,产生CO2的体积(标准状况)与所加盐酸的体积关系如图所示。
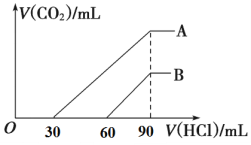
(1)A曲线表明,原溶液通入CO2 ________mL(标准状况)。
(2)B曲线表明,原溶液通入CO2后,所得溶液中溶质的物质的量之比为__________。
(3)原NaOH溶液的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O,下列说法正确的是
A. O2和S2O32-是氧化剂,Fe2+是还原剂
B. 每生成1mol Fe3O4,则转移电子为2mol
C. 参加反应的氧化剂与还原剂的物质的量之比为1:1
D. 若有2mol Fe2+被氧化,则被Fe2+还原的O2为0.5mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com