
【题目】下列3d能级的电子排布图正确的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
【答案】B
【解析】
核外电子排布满足:①能量最低原理:电子先排布在能量低的能级中,然后再向能量高的能级中排布;②每个轨道最多只能容纳两个电子,且自旋方向相反;③简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子。
A.同一轨道自旋方向相同,违反泡利不相容原理,每个轨道最多只能容纳两个电子且自旋相反,故A错误;
B.3d能级中电子排布符合简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子,每个轨道最多只能容纳两个电子且自旋相反,故B正确;
C.3d能层有6个电子,应在5个不同的轨道,不符合洪特规则,故C错误;
D.同一轨道自旋方向相同,违反泡利不相容原理,故D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】![]() 为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,
为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,![]() 同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( )
同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( )
A.纯净的E元素的最高价氧化物可用于制造光导纤维
B.![]() 三种元素形成的化合物中一定只含共价键
三种元素形成的化合物中一定只含共价键
C.由元素![]() 组成的某种化合物可与
组成的某种化合物可与![]() 反应生成
反应生成![]()
D.元素A与![]() 形成的常见化合物中,热稳定性最好的是AD
形成的常见化合物中,热稳定性最好的是AD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜合金以纯铜为基体加入一种或几种其他元素所构成的合金,是人类使用最早的金属材料。
(1)电解精炼铜的实验中使用的粗铜含有Cu和少量的Zn、Ag、Au、Cu2Te及其他化合物,请写出电解精炼铜时,阳极发生的电极反应式__________、______________。
(2)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如图:(已知TeO2是两性氧化物,微溶于水,易溶于强酸和强碱)
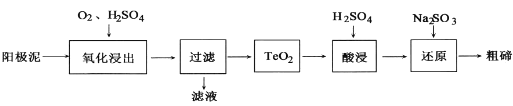
①“氧化浸出”时为使碲元素沉淀充分应控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致碲沉淀不完全,原因是_____.
②“过滤”用到的玻璃仪器有____。
③“还原”时发生的离子方程式是________。
④判断粗碲洗净的方法是_________。
⑤在滤液中逐滴加入氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的透明溶液。写出此蓝色沉淀溶解的离子方程式_______。根据以上实验判断NH3和H2O与Cu2+的配位能力:NH3_____H2O(填“>”或“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300℃时,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g) +Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=_____________
(2)能判断该反应已经达到平衡状态的是_____________
A.生成X的速率是生成Z的速率的2倍
B.容器内压强保持不变
C.容器内气体的密度保持不变
D.容器内各气体的浓度保持不变
(3)要提高上述反应的转化率,可采取的措施是_____________(任写一种)。
(4)温度为300℃时,该反应的化学平衡常数K=_______________
(5)若起始时向该容器中充入X、Y、Z各0.20 mol,则反应将向____(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数与上述平衡相比______(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是______mol。
(2)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是________,又变为棕黄色的原因是用离子方程式解释___________________________.
(3)在100mLFeBr2溶液中通入标况下2.24LCl2,溶液溶液中有1/4的Br- 被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_________________。
(4)将Al、Al2O3和Al(OH)3的混合物恰好与NaOH溶液反应,反应后溶液中溶质的化学式_________。向反应后的溶液中通入过量CO2,反应的离子方程式为______。
(5)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
①写出该反应的化学方程式___________,反应中生成0.2mol HNO3,转移的电子数目为_______。
②NF3无色、无臭,但一旦在空气中泄漏,还是易于发现,判断该气体泄漏时的现象是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图为CO2分子晶体结构的一部分,观察图形。试说明每个 CO2分子周围有________个与之紧邻且等距的 CO2分子;该结构单元平均占有________个CO2分子。

(2)在40 GPa高压下,用激光器加热到1800 K时,人们成功制得原子晶体干冰,其结构和性质与SiO2原子晶体相似,下列说法正确的是________。
A.原子晶体干冰易升华,可用作制冷剂
B.原子晶体干冰有很高的熔点和沸点
C.原子晶体干冰的硬度小,不能用作耐磨材料
D.原子晶体干冰在一定条件下可与氢氧化钠反应
E.每摩尔原子晶体干冰中含有4 mol C—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
![]() 离子化合物含离子键,也可能含极性键或非极性键
离子化合物含离子键,也可能含极性键或非极性键
![]() 硫酸的酸性大于碳酸的酸性,所以非金属性
硫酸的酸性大于碳酸的酸性,所以非金属性![]()
![]() 含金属元素的化合物不一定是离子化合物
含金属元素的化合物不一定是离子化合物
![]() 由非金属元素组成的化合物一定是共价化合物
由非金属元素组成的化合物一定是共价化合物
![]() 熔融状态能导电的化合物是离子化合物
熔融状态能导电的化合物是离子化合物
![]() 由分子组成的物质中一定存在共价键
由分子组成的物质中一定存在共价键
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO![]() +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为______(标准状况),被氧化的HCl的物质的量为____。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的同分异构体数目判断正确的是( )
A. C5H10共有6种单烯烃同分异构体B. 1-甲基环己烷(![]() )共有4种一氯代物
)共有4种一氯代物
C. C6H14共有5种同分异构体D. CH2Cl2共有两种同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com