
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:
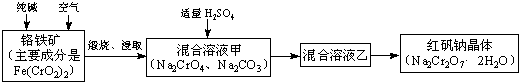
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 。为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
【知识点】氧化物书写形式、反应速率影响因素、平衡移动
【答案解析】(1)FeO·Cr2O3(2分)
(2)粉碎矿石、升高温度(2分)
(3)① 少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物。(2分)
② Na2Cr2O7和Na2SO4(2分)
(4)c(CrO42-)2c(H+)2/c(Cr2O72-) (2分) 正向(2分)
(5) 4 6 19 8 3 14 (3分)
解析:(1)化学上可将某些盐写成氧化物的形式,规律是:活泼金属氧化物·较不活泼金属氧化物·非金属氧化物·水;Fe(CrO2)2可写成FeO·Cr2O3;
(2)加快该反应的反应速率,可采取的措施有增大接触面积、升高温度、增大浓度、增大压强、加入催化剂等,本实验是固体、气体之间的反应,可以粉碎矿石、升高温度来提高反应速率;
(3) ①CrO42-在不同的酸性溶液中有不同的反应, 往混合溶液甲中加入硫酸少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;② 反应后,混合溶液乙得到Na2Cr2O7和Na2SO4;
(4)平衡常数是生成物浓度幂之积比反应物浓度幂之积,即K= c(CrO4-)2c(H+)2/c(Cr2O72-);若继续加水稀释,平衡将正向移动;
(5)反应中Cr由+6价降到+3价,2个Cr得6个电子,S由-2价升高到+2价,2个S失8个电子,根据最小公倍数是24进行配平:
4Cr2O72-+6S2-+19H2O ==8Cr(OH)3+3S2O32-+14OH-。
【思路点拨】本题考查的氧化物书写形式、反应速率影响因素、平衡移动、氧化还原反应配平等基本题型,考查学生对基础知识的掌握情况,题目很容易解答。


科目:高中化学 来源: 题型:
一定条件下,向容积为2 L的密闭容器中充入一定量A和足量B,发生反应如下:2A(g)+B(s)2C(g),测得相关数据如下,分析可知下列说法不正确的是
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol·L-1 | 1 | 2 | 1 |
| c(A)平衡/mol·L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
A.实验Ⅲ的化学平衡常数K<1 B.实验放出的热量关系为b=2a
C.实验Ⅲ在30 min达到平 衡,30 min内A的速率:v(A)=0.002 5 mol·L-1·min-1
衡,30 min内A的速率:v(A)=0.002 5 mol·L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图10所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
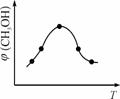
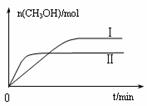
图10 图11
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图11所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比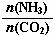 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
己烯雌酚是一种激素类药物,其结构简式如下图所示。下列有关叙述中不正确的是
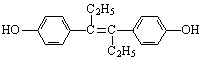 A.己烯雌酚的分子式为C18H20O2
A.己烯雌酚的分子式为C18H20O2
B.己烯雌酚分子中一定有16个碳原子共平面
C.己烯雌酚为芳香族化合物
D.己烯雌酚可发生加成、取代、氧化、加聚、酯化、硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W,它们的原子序数依次增大。X与Z同主族,并且原子序数之和为20。Y原子的质子数为Z原子的质子数的一半,W原子的最外层电子数比Y原子的最外层电子数多2个。下列叙述正确的是
A. Y的最高价氧化物对应的水化物可与其气态氢化物发生化合反应
B. 原子半径Z>W>Y>X
C. 气态氢化物的稳定性Z>W
D. X的气态氢化物与足量W单质在光照条件下反应生成物均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
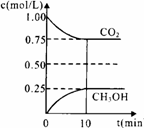 CO2(g)+3H2(g)
CO2(g)+3H2(g)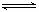 CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
①能说明该反应已达平衡状态的是 。
A. CO2的体积分数在混合气体中保持不变
B. 混合气体的平均相对分子质量不随时间的变化而变化
C. 单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D. 反应中H2O与CH3OH的物质的量浓度之比为1:1,且 保持不变
②下列措施中能使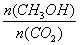 增大的是 (选填编号)。
增大的是 (选填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K= 。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度
C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
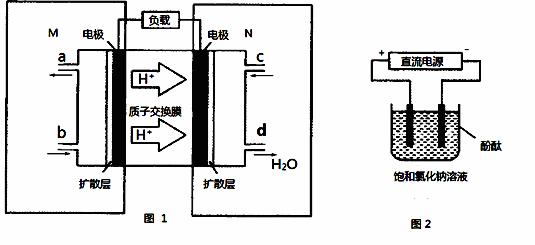
①M区发生反应的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为
(忽略溶液体积变化)。
(3) 有一种用CO2生产甲醇燃料的方法:
已知: CO2(g)+3H2(g)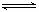 CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在甲、乙、丙、丁四个烧杯内分别放入0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁所得溶液里溶质的质量分数大小顺序是 ( )
A.甲<乙<丙<丁 B.丁<甲<乙=丙
C.甲=丁<乙=丙 D.丁<甲<乙<丙
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量某无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| B | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向溶液X中滴加稀盐酸 | 有气体产生 | 溶液X 中一定含有CO32- |
| D | 向含H2SO4的淀粉水解液中加入新制的Cu(OH)2,煮沸 | 没有砖红色沉淀 | 淀粉未水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com