
研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
C(石墨) +CO2(g) = 2CO(g) △H2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中,发生上述反应。反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图10所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
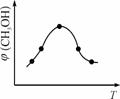
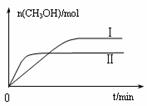
图10 图11
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图11所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应方程式为 。当氨碳比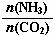 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极反应的方程式为  。
。
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
铬及其化合物应用广泛。例如用经硫酸酸化处理的三氧化铬(CrO3)硅胶测试司机呼出的气体,根据硅胶颜色的变化可以判断司机是否酒驾
(1)基态铬原子的电子排布式为 。
(2)右图是部分主族元素第一电离能梯度图,图中,a点对应
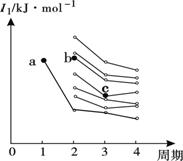 的元素为氢,b、c两点对应的元素分别为 、
的元素为氢,b、c两点对应的元素分别为 、
(填元素符号)。
(3)测试过程中,乙醇被氧化为乙醛(CH3CHO)。乙醇与乙醛
的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
(4)氯化铬酰(CrO2Cl2)可用作染料溶剂,熔点为-96.5℃,沸点为117℃,能与四氯化碳等有机溶剂互溶。氯化铬酰晶体属于 (填晶体类型)。
(5)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+ 形式存在。
①上述溶液中,不存在的微粒间作用力是 (填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
②[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是 。
(6)在酸性溶液中,H2O2能与重铬酸盐作用生成蓝色的CrO5,离子方程式为:
4H2O2 + 2H+ + Cr2O72- =2CrO5 + 5H2O根据下图所示Cr2O72-和CrO5的结构判断,上述反应 (填“是”或“不是”)氧化还原反应。
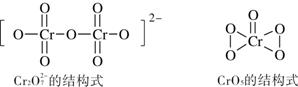
查看答案和解析>>
科目:高中化学 来源: 题型:
A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,该混合物成分的分析方案如图

下列分析不正确的是
A.当m1>m2时,溶液a中的阴离子只有1种
B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+
C.要确定混合物中是否含有Al,可取A加入适量稀盐酸
D.当m2-m3=2.96 g时,Fe3O4的质量至少为2.32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2NO2 2NO+O2 在密闭容器中反应,达到平衡状态的标志是:( )
2NO+O2 在密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B.②③⑤ C.①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)一定条件下,发生反应CO(g)+H2O(g)  CO2(g)+H2(g),向2 L密闭容器中通入2 mol CO(g)、1 mol H2O(g),2 min 后反应达到平衡时,测得CO的物质的量为1.6 mol,用H2O(g)表示该反应速率为 ,此温度下,该反应的平衡常数为 。若往容器中再加入2 mol CO(g),则重新
CO2(g)+H2(g),向2 L密闭容器中通入2 mol CO(g)、1 mol H2O(g),2 min 后反应达到平衡时,测得CO的物质的量为1.6 mol,用H2O(g)表示该反应速率为 ,此温度下,该反应的平衡常数为 。若往容器中再加入2 mol CO(g),则重新 达到平衡时的CO总转化率
达到平衡时的CO总转化率
20%(填“>”、“<”或“=”)。
(2)在一密闭容器中发生反应2NO2 2NO+O2 ΔH>0,反应
2NO+O2 ΔH>0,反应 过程中NO2的浓度随时间变化的情况如下图所示:
过程中NO2的浓度随时间变化的情况如下图所示:
若曲线A、B分别表示的是该反应在某不同条件 下的反应情况,则曲线B此条件可能是________(填“增大压强”、“减小压强”、“升高温度”、“降低温度”或“使
下的反应情况,则曲线B此条件可能是________(填“增大压强”、“减小压强”、“升高温度”、“降低温度”或“使 用催化剂”)。
用催化剂”)。
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)  4NO2(g)+O2(g) ②2NO2(g)
4NO2(g)+O2(g) ②2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6 mol·L-1,c(O2)=1.3 mol·L-1,则反应②中NO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:
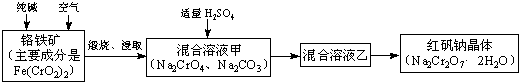
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 。为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨烯是一种由碳原子组成六角形成蜂巢晶格的平面薄膜,其结构模型见右图。下列关于石墨烯的说法正确的是 ( )

A.是一种新型化合物 B.与石墨互为同位素
C.晶体中碳原子键全部是碳碳单键 D.是一种有发展前途的导电材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com