
�����仯����Ӧ�ù㷺�������þ������ữ����������������CrO3���轺����˾�����������壬���ݹ轺��ɫ�ı仯�����ж�˾���Ƿ�Ƽ�
��1����̬��ԭ�ӵĵ����Ų�ʽΪ ��
��2����ͼ�Dz�������Ԫ�ص�һ�������ݶ�ͼ��ͼ�У�a���Ӧ
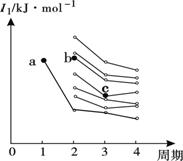 ��Ԫ��Ϊ�⣬b��c�����Ӧ��Ԫ�طֱ�Ϊ ��
��Ԫ��Ϊ�⣬b��c�����Ӧ��Ԫ�طֱ�Ϊ ��
����Ԫ�ط��ţ���
��3�����Թ����У��Ҵ�������Ϊ��ȩ��CH3CHO�����Ҵ�����ȩ
����Է������������Ҵ��ķе㣨78.5�棩ȴ����ȩ�ķе㣨20.8�棩�߳����࣬��ԭ���� ��
��4���Ȼ�������CrO2Cl2��������Ⱦ���ܼ����۵�Ϊ-96.5�棬�е�Ϊ117�棬�������Ȼ�̼���л��ܼ����ܡ��Ȼ������������� ��������ͣ���
��5����CrCl3��6H2O�ܽ�������ˮ�еõ�����ɫ��Һ����Һ��Cr3+��[Cr(H2O)5Cl]2+ ��ʽ���ڡ�
��������Һ�У������ڵ������������� �����ţ���
A�����Ӽ� B�����ۼ� C�������� D����λ�� E�����»���
��[Cr(H2O)5Cl]2+��Cr3+�Ĺ���ӻ���ʽ����sp3�������� ��
��6����������Һ�У�H2O2�����ظ���������������ɫ��CrO5�����ӷ���ʽΪ��
4H2O2 + 2H+ + Cr2O72- ��2CrO5 + 5H2O������ͼ��ʾCr2O72-��CrO5�Ľṹ�жϣ�������Ӧ ����ǡ����ǡ���������ԭ��Ӧ��
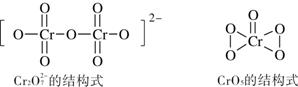
��֪ʶ�㡿��������Ų��������ijɼ����������������������۵㡢�����ļ���
���𰸽�������15�֣�����ע����ÿ��2�֣���1�� ��Ar��3d54s1 ��2�� O Si ��3�� �Ҵ����Ӽ�������������ȩ���Ӽ䲻������� ��4�� ���Ӿ��� ��1�֣�
��5�� �� A��C �����Cr3+��ȡsp3�ӻ�����ֻ��4���ɼ���������γ�6����λ��
��6�� ����
��������1������24��Ԫ�أ����ݺ�������Ų����ɺ�d�����������ȶ��ԣ�ԭ�ӵ����Ų�ʽΪ��Ar��3d54s1��2���ڶ����ڵĵ�һ������Ӧ����N>O>C��ΪN��2P���������Ƚ��ȶ�����һ�����ܴ������ڵ��м��ǹ�Ԫ�ء�b��c�����Ӧ��Ԫ�طֱ�ΪO ��Si ��3���Ҵ����Ӽ�������������ȩ���Ӽ䲻������������������Զ���ڷ��»�������4�����������۷е���Եͼ��ܽ��Ե��ص��ж�Ϊ���Ӿ��塣��5����Cr3+��[Cr(H2O)5Cl]2+ ��ʽ���ڣ�����λ�����������Ӽ�Ҳ���ǽ������������Cr3+��ȡsp3�ӻ�����ֻ��4���ɼ���������γ�6����λ����6������ͼ��ʾCr2O72-��CrO5�Ľṹ�жϣ���Ԫ�ض����γ�6����ѧ����Ϊ+6�ۣ���Ӧǰ�ϼ�û�仯�����Բ���������ԭ��Ӧ��
��˼·�㲦�����Ȿ��Ŀ�ۺ��Խϴ��漰���塢��ѧ�����ӻ��������������ȣ�ע���һ�����ܵĹ��ɼ��쳣����Ϊ�״��㡣



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
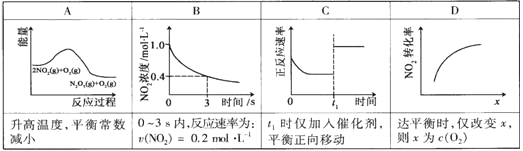
��������������������Լ�����������ӦΪ��2NO2(g)+O3(g) N2O5(g)+O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���ǣ���������
N2O5(g)+O2(g)������Ӧ�ں����ܱ������н��У������ɸ÷�Ӧ���ͼ���������ж���ȷ���ǣ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʽΪC3H6Cl2���л������һԪ�ȴ���Ӧ������������ͬ���칹�壬��ԭC3H6Cl2�������ǣ� ����
A��1,2�����ȱ��� B��1,1�����ȱ���
C��1,3�����ȱ��� D��2,2�����ȱ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1912���ŵ������ѧ�����跨����ѧ��V.Grignard,���ڱ�������������Grignard�Լ���±������þ���㷺�������л��ϳ��еľ��ס�Grignard�Լ��ĺϳɷ����ǣ�RX��Mg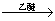 RMgX��Grignard�Լ��������ɵ�±������þ������ʻ��ṹ�Ļ����ȩ��ͪ�ȣ�������Ӧ����ˮ����ܺϳɸ���ָ���ṹ�Ĵ���
RMgX��Grignard�Լ��������ɵ�±������þ������ʻ��ṹ�Ļ����ȩ��ͪ�ȣ�������Ӧ����ˮ����ܺϳɸ���ָ���ṹ�Ĵ���
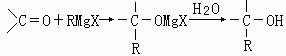
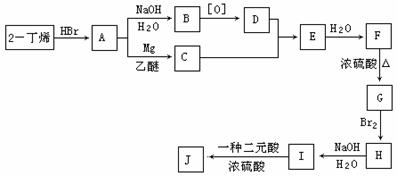
����2����ϩ�ͱ�Ҫ������Ϊԭ�Ϻϳ�3��4��������3�������������ϳ�һ�ַ���ʽΪC10H16O4����Ԫ��������J�������ʾ���һ���ĶԳ��ԣ��ϳ���·���£�
�밴Ҫ����գ�
��1�� 3��4��������3�������ǣ� ������ţ���E�Ľṹ��ʽ�� ��
��2��C��E�ķ�Ӧ������ ��F��G�ķ�Ӧ������ ��
��3��д�����л�ѧ��Ӧ����ʽ���л������ýṹ��ʽ��ʾ����
A��B ��
B��D ��
F��G ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ù������(�ṹ����ͼ)��������ֲ������ϸ����ֳ��õ�ҩ�����˵����ȷ����
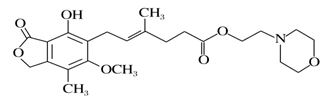
A. ù������������ˮ
B. ù����������Ũ��ˮ����ȡ����Ӧ
C. 1 molù���������뺬4 mol NaOH��ˮ��Һ��ȫ��Ӧ
D. ù�������ȿ��Դ����⣬�ֿ���ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���й�������������й���������ȷ���ǣ�������
| �� | A�� | ���������Ҫ�����ǣ�������ƿ���ƾ��ơ�����̨�������ܡ���ƿ���¶ȼ� |
| �� | B�� | �������ʹ�õ��¶ȼƵ�ˮ����Ӧ���뵽Һ���� |
| �� | C�� | ��������ƿ�ڷ����������Ƭ��Ŀ���Ƿ�ֹ���� |
| �� | D�� | �����ܽ���ˮ�ķ������½��ϳ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������У�����ԭ����Ŀ�����ǣ�������
| �� | A�� | 0.9molH2O | B�� | 0.3molH2SO4 | C�� | 0.2molNH3 | D�� | 0.4molCH4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ȷ��ʾ���з�Ӧ�����ӷ���ʽ����
A��Fe3O4��������ϡHNO3�У�Fe3O4��8H��===Fe2����2Fe3����4H2O
B��NH4HCO3��Һ������Ba(OH)2��Һ��ϣ�HCO ��Ba2����OH��===BaCO3����H2O
��Ba2����OH��===BaCO3����H2O
C����������SO2ͨ��Ca(ClO)2��Һ�У� SO2��ClO����H2O===HClO�� HSO
D����0.2 mol��L��1 NH4Al(SO4)2��Һ��0.3 mol��L��1 Ba(OH)2��Һ�������ϣ�
2Al3����3SO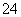 ��3Ba2����6OH��===2Al(OH)3����3BaSO4��
��3Ba2����6OH��===2Al(OH)3����3BaSO4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���塣
��1����CO2�뽹̿��������CO��CO�����������ȡ�
��֪��Fe2O3(s) + 3C(ʯī) = 2Fe(s) + 3CO(g) ��H 1 = +489.0 kJ��mol��1
C(ʯī) +CO2(g) = 2CO(g) ��H2 = +172.5 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ ��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) +3H2(g) CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
��ȡһ�����CO2��H2�Ļ������(���ʵ���֮��Ϊ1��3)����������ܱ������У�����������Ӧ����Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ��ͼ10��ʾ����÷�Ӧ�Ħ�H 0(�>������<������)��
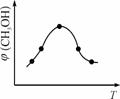 ��
�� 
ͼ10 ͼ11
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ11��ʾ������I�����Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>������<������)��
��3����CO2Ϊԭ�ϻ����Ժϳɶ������ʡ�
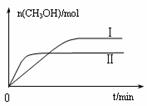
�ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ ������̼�� ��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ ��
��3����ƽ��ʱCO2��ת����Ϊ60%����NH3��ƽ��ת����Ϊ ��
����������Һ������ʽ��е�⣬CO2�ڵ缫�Ͽ�ת��Ϊ���飬�õ缫��Ӧ�ķ���ʽΪ  ��
��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com