
下列物质中,含氢原子数目最多的是( )
|
| A. | 0.9molH2O | B. | 0.3molH2SO4 | C. | 0.2molNH3 | D. | 0.4molCH4 |
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.苯和溴水振荡后,由于发生化学反应而使溴水的水层颜色变浅
B.酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷
C.煤中含有苯和甲苯,可以用先干馏,后蒸馏的方法把它们分离出来
D.石油中含有C5~C11的烷烃,可以通过分馏得到汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
铬及其化合物应用广泛。例如用经硫酸酸化处理的三氧化铬(CrO3)硅胶测试司机呼出的气体,根据硅胶颜色的变化可以判断司机是否酒驾
(1)基态铬原子的电子排布式为 。
(2)右图是部分主族元素第一电离能梯度图,图中,a点对应
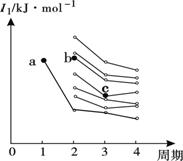 的元素为氢,b、c两点对应的元素分别为 、
的元素为氢,b、c两点对应的元素分别为 、
(填元素符号)。
(3)测试过程中,乙醇被氧化为乙醛(CH3CHO)。乙醇与乙醛
的相对分子质量相差不大,但乙醇的沸点(78.5℃)却比乙醛的沸点(20.8℃)高出许多,其原因是 。
(4)氯化铬酰(CrO2Cl2)可用作染料溶剂,熔点为-96.5℃,沸点为117℃,能与四氯化碳等有机溶剂互溶。氯化铬酰晶体属于 (填晶体类型)。
(5)将CrCl3·6H2O溶解在适量水中得到深绿色溶液,溶液中Cr3+以[Cr(H2O)5Cl]2+ 形式存在。
①上述溶液中,不存在的微粒间作用力是 (填标号)。
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
②[Cr(H2O)5Cl]2+中Cr3+的轨道杂化方式不是sp3,理由是 。
(6)在酸性溶液中,H2O2能与重铬酸盐作用生成蓝色的CrO5,离子方程式为:
4H2O2 + 2H+ + Cr2O72- =2CrO5 + 5H2O根据下图所示Cr2O72-和CrO5的结构判断,上述反应 (填“是”或“不是”)氧化还原反应。
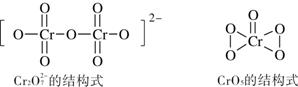
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的量的说法中正确的是( )
|
| A. | 物质的量是国际单位制中的七个基本物理量之一 |
|
| B. | 物质的量实质上就是物质的质量 |
|
| C. | 物质的量是一种物理量的单位 |
|
| D. | 摩尔既是物质的量的单位,又是粒子数量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,该混合物成分的分析方案如图

下列分析不正确的是
A.当m1>m2时,溶液a中的阴离子只有1种
B.生成蓝色溶液的离子方程式为Cu+2Fe3+===Cu2++2Fe2+
C.要确定混合物中是否含有Al,可取A加入适量稀盐酸
D.当m2-m3=2.96 g时,Fe3O4的质量至少为2.32 g
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:
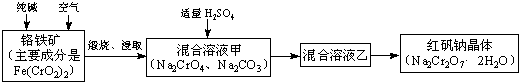
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 。为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com