
某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为 ,可知所配成的盐酸溶液的物质的量浓度为 .
 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列说法中错误的是
A.在一定温度压强下,14 gN2所含的体积可能为11.2 L
B.标准状况下,足量NaOH溶液与2.24 LCl2反应,转移电子数目为0.1 NA
C.标准状况下,11.2 LH2O中含有的电子数为5NA
D. 加热条件下,足量Cl2与1 molFe粉充分反应,转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
霉酚酸酯(结构如下图)是器官移植中抑制细胞增殖最常用的药物。下列说法正确的是
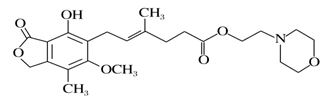
A. 霉酚酸酯能溶于水
B. 霉酚酸酯能与浓溴水发生取代反应
C. 1 mol霉酚酸酯能与含4 mol NaOH的水溶液完全反应
D. 霉酚酸酯既可以催化加氢,又可以使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 在常温常压下,11.2LN2含有的分子数为0.5NA |
|
| B. | 标准状况下,22.4LH2和O2的混合物所含有的分子数为NA |
|
| C. | 标准状况下,18gH2O的体积是22.4L |
|
| D. | 1molSO3的体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是
A.Fe3O4溶于足量稀HNO3中:Fe3O4+8H+===Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O===HClO+ HSO
D.将0.2 mol·L-1 NH4Al(SO4)2溶液与0.3 mol·L-1 Ba(OH)2溶液等体积混合:
2Al3++3SO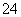 +3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,能达到实验目的的是
| 选项 | A | B | C | D |
| 装置 |
|
|
|
|
| 目的 | 除去Cl2中含有的少量HCl | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量纯净的CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,向容积为2 L的密闭容器中充入一定量A和足量B,发生反应如下:2A(g)+B(s)2C(g),测得相关数据如下,分析可知下列说法不正确的是
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol·L-1 | 1 | 2 | 1 |
| c(A)平衡/mol·L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
A.实验Ⅲ的化学平衡常数K<1 B.实验放出的热量关系为b=2a
C.实验Ⅲ在30 min达到平 衡,30 min内A的速率:v(A)=0.002 5 mol·L-1·min-1
衡,30 min内A的速率:v(A)=0.002 5 mol·L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
 CO2(g)+3H2(g)
CO2(g)+3H2(g)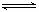 CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
①能说明该反应已达平衡状态的是 。
A. CO2的体积分数在混合气体中保持不变
B. 混合气体的平均相对分子质量不随时间的变化而变化
C. 单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D. 反应中H2O与CH3OH的物质的量浓度之比为1:1,且 保持不变
②下列措施中能使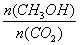 增大的是 (选填编号)。
增大的是 (选填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K= 。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度
C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
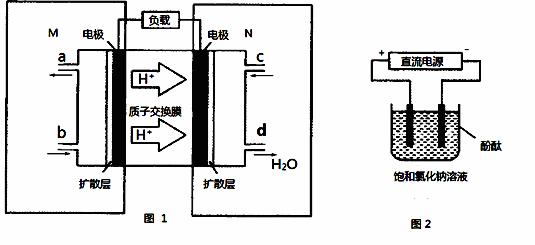
①M区发生反应的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为
(忽略溶液体积变化)。
(3) 有一种用CO2生产甲醇燃料的方法:
已知: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com