
【题目】Ⅰ.按要求填空
(1)5.4gH2O物质的量为____________mol,约含有___________________个原子;
(2)已知1.204×1023个X气体的质量是6.4g。则X气体的摩尔质量是_________ g/mol;
(3)同温同压下,同体积的甲烷CH4和CO2质量之比为________,质子数之比_______;
(4)VLAl2(SO4)3溶液中含Al3+ag,该Al2(SO4)3溶液的物质的量浓度为_____mol/L,取出![]() L再加入水稀释到4VL。则稀释后溶液中SO42-的物质的量浓度是_____mol/L。
L再加入水稀释到4VL。则稀释后溶液中SO42-的物质的量浓度是_____mol/L。
Ⅱ.按要求书写下列反应的方程式
(1)亚硫酸氢钠电离方程式(NaHSO3)________________________________________________;
(2)醋酸溶液与NaHCO3溶液反应的离子方程式为________________________________;
(3)0.8molL﹣1NaHSO4与0.4molL﹣1Ba(OH)2溶液等体积混合,反应的离子方程式为___________;
(4)黑火药爆炸的化学方程式为________________________________。
Ⅲ.请配平以下化学方程式
(1)____FeSO4+____K2O2+____H2O =____ Fe(OH) 3+____ Fe2(SO4) 3+____KOH
(2)_____BiO3-+_____Mn2++____=_____Bi3++_____ MnO4- +____
【答案】0.3 0.9×6.02×1023或0.9 NA 32g/mol 4:11 5:11 ![]() mol/L
mol/L ![]() mol/L NaHSO3=Na++HSO3- CH3COOH+HCO3- =CO2↑+CH3COO-+H2O Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O S+2KNO3+3C
mol/L NaHSO3=Na++HSO3- CH3COOH+HCO3- =CO2↑+CH3COO-+H2O Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O S+2KNO3+3C ![]() K2S+N2↑+3CO2↑ 6 3 6 2 2 6 5 2 14H+ 5 2 7H2O
K2S+N2↑+3CO2↑ 6 3 6 2 2 6 5 2 14H+ 5 2 7H2O
【解析】
Ⅰ.根据n=![]() =
=![]() =
=![]() =cV进行计算;
=cV进行计算;
Ⅱ.(1)亚硫酸氢钠为强电解质,在溶液中完全电离出钠离子和亚硫酸氢根离子;
(2)亚硫酸氢钠与醋酸反应生成醋酸钠、水、二氧化碳;
(3)根据反应的方程式书写;
(4)根据反应的方程式书写;
Ⅲ.根据电子得失守恒、电荷守恒以及原子守恒分析解答。
Ⅰ.(1)根据n=![]() 可知,5.4gH2O物质的量为
可知,5.4gH2O物质的量为![]() =0.3mol,约含有0.3mol×3×NA/mol=0.9 NA= 0.9×6.02×1023个原子;
=0.3mol,约含有0.3mol×3×NA/mol=0.9 NA= 0.9×6.02×1023个原子;
(2)已知1.204×1023个X气体的质量是6.4g,X气体的物质的量是![]() =0.2mol,所以X气体的摩尔质量是
=0.2mol,所以X气体的摩尔质量是![]() =32g/mol;
=32g/mol;
(3)同温同压下,根据阿伏加德罗定律可知同体积的甲烷(CH4)和CO2分子数之比为1:1,物质的量之比1:1,质量之比为1mol×16g/mol:1mol×44 g/mol=4:11;质子数之比为(6+1×4):(6+8×2)=5:11;
(4)VLAl2(SO4)3溶液中含Al3+ ag,则Al3+的物质的量为![]() =
=![]() mol,硫酸铝的物质的量是
mol,硫酸铝的物质的量是![]() mol =
mol =![]() mol ,所以溶液的物质的量浓度为
mol ,所以溶液的物质的量浓度为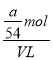 =
=![]() mol/L;取出
mol/L;取出![]() L再加入水稀释到4VL。则稀释后溶液中SO42-的物质的量浓度是
L再加入水稀释到4VL。则稀释后溶液中SO42-的物质的量浓度是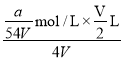 ×3=
×3=![]() mol/L;
mol/L;
Ⅱ.(1)亚硫酸氢钠在溶液中完全电离出钠离子和亚硫酸氢根离子,电离方程式为:NaHSO3=Na++HSO3-;
(2)亚硫酸氢钠与醋酸反应生成醋酸钠、水、二氧化碳,发生的离子反应为CH3COOH+HCO3- =CO2↑+CH3COO-+H2O;
(3)0.8molL﹣1NaHSO4与0.4molL﹣1Ba(OH)2溶液等体积混合,即NaHSO4与Ba(OH)2按照物质的量2:1反应,氢离子与氢氧根离子恰好反应,反应的离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(4)黑火药爆炸是硫、硝酸钾和碳反应生成硫化钾、氮气和二氧化碳,反应的化学方程式为S+2KNO3+3C ![]() K2S+N2↑+3CO2↑;
K2S+N2↑+3CO2↑;
Ⅲ.(1)FeSO4中的Fe元素由+2→+3,升高1,而K2O2的O元素由-1→-2,降低1×2,两者最小公倍数为2,根据电荷守恒以及原子守恒可知反应的方程式为6FeSO4+3K2O2+6H2O =2Fe(OH) 3+2Fe2(SO4) 3+6KOH;
(2)Mn2+中的Mn元素由+2→+7,升高5,而BiO3-的Bi元素由+5→+3,降低2,两者最小公倍数为10,根据电荷守恒以及原子守恒可知反应的方程式为5BiO3-+2Mn2++14H+=5Bi3++2MnO4- +7 H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. O2 的摩尔质量是32 g B. 1 mol Na2O 的质量是62 g
C. 18 g H2O 含有氢原子数目为1 mol D. 22.4 L SO2 的物质的量是 1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是( )
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105 Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.23g钠所含的核外电子数为1.1NA
B.lLl![]() 乙醛溶液中含有分子的数目为NA
乙醛溶液中含有分子的数目为NA
C.4.48 L![]() 和CO混合气体完全燃烧,消耗的氧分子数目为 0.1NA
和CO混合气体完全燃烧,消耗的氧分子数目为 0.1NA
D.2.13 g氯气与足量热的NaOH溶液充分反应生成![]() 和
和![]() 时,转移的电子数目为0.05NA
时,转移的电子数目为0.05NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
①MnO+Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
②MnO+CuS+H+―→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是______(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为85
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
Ⅱ.在稀硫酸中,MnO和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO+5e-+8H+===Mn2++4H2O
(2)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。
(3)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是______mol。
Ⅲ.高锰酸钾溶液与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
(4)若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. ![]() 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面
B. ![]() 中有8个碳原子可能在同一条直线上
中有8个碳原子可能在同一条直线上
C. 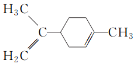 所有碳原子一定在同一平面上
所有碳原子一定在同一平面上
D. ![]() 至少有16个原子共平面
至少有16个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组的同学为测定某Na2CO3和NaCl的固体混合物样品中Na2CO3的质量分数进行了以下实验。请你参与并完成对有关问题的解答:

(1)甲同学用图1所示装置测定CO2的质量。实验时稀硫酸是与样品中的__________(填“Na2CO3”或“NaCl”)发生反应,仪器b的名称是__________,洗气瓶c中盛装的是浓硫酸,此浓硫酸的作用是____________________。
(2)乙同学用图2所示装置,取一定质量的样品m g和足量稀硫酸反应进行实验,完成样品中Na2CO3质量分数的测定。
①实验前,检查该装置气密性的方法是先打开活塞a,由b注入水至其下端玻璃管中形成一段水柱,再将针筒活塞向内推压,若b下端玻璃管中的___________________,则装置气密性良好。
②在实验完成时,能直接测得的数据是CO2的______(填“体积”或“质量”)。
(3)丙同学用下图所示方法和步骤进行实验:

①操作Ⅰ涉及的实验名称有:__________、洗涤;操作Ⅱ涉及的实验名称有干燥、__________。
②丙同学测得样品中Na2CO3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
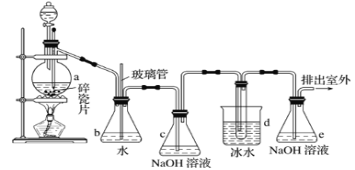
【题目】抗爆剂的添加剂常用1,2-二溴乙烷。如图为实验室制备1,2-二溴乙烷的装罝图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
已知:CH3CH2OH![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:①_______________;如果实验时d装罝中导管堵塞,你认为可能的原因是②_______________;安全瓶b还可以起到的作用是③_______________。
(2)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_____________________。
(3)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:______________、______________(写出两条即可)。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为___________,要进一步提纯,下列操作中必需的是_____________ (填字母)。
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装罝中盛冰水的烧杯,改为将冷水直接加入到d装罝的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述正确的是( )
A.图甲表示相同温度下,在不同容积的容器中进行反应2BaO2(s)![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
B.图乙表示2NO2(g)![]() N2O4(g)中反应物与生成物的浓度随时间的变化,且在t1时刻达到平衡
N2O4(g)中反应物与生成物的浓度随时间的变化,且在t1时刻达到平衡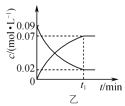
C.图丙表示向0.1mol·L-1NH4Cl溶液中滴加0.1mol·L-1盐酸时,溶液中![]() 随盐酸体积的变化关系
随盐酸体积的变化关系
D.图丁表示向pH、体积均相同的HCl、CH3COOH溶液中分别加入过量锌粉,产生的H2体积随时间的变化,其中曲线a表示HCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com