
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.23g钠所含的核外电子数为1.1NA
B.lLl![]() 乙醛溶液中含有分子的数目为NA
乙醛溶液中含有分子的数目为NA
C.4.48 L![]() 和CO混合气体完全燃烧,消耗的氧分子数目为 0.1NA
和CO混合气体完全燃烧,消耗的氧分子数目为 0.1NA
D.2.13 g氯气与足量热的NaOH溶液充分反应生成![]() 和
和![]() 时,转移的电子数目为0.05NA
时,转移的电子数目为0.05NA
【答案】D
【解析】
A.1个钠原子核外有11个电子,23 g钠的物质的量为1 mol,故1 mol钠所含的核外电子为11mol,所含的核外电子数为11NA,故A错误;
B.1L1![]() 乙醛溶液中除含乙醛外,还含有
乙醛溶液中除含乙醛外,还含有![]() ,故所含有分子的数目大于
,故所含有分子的数目大于![]() ,故B错误;
,故B错误;
C.选项中没有指明气体是否在标准状况下,所以4.48 L![]() 和CO的混合气体不一定为0.2 mol,所消耗氧气的物质的量也无法确定,故C错误;
和CO的混合气体不一定为0.2 mol,所消耗氧气的物质的量也无法确定,故C错误;
D.氯气与热NaOH溶液发生反应生成![]() 、
、![]() 和
和![]() 的化学方程式为
的化学方程式为![]() ,由上述化学方程式可知,3 mol
,由上述化学方程式可知,3 mol![]() 发生反应时转移5 mol电子,2.13 g氯气的物质的量为0.03 mol,转移电子为0.05 mol,故D正确;
发生反应时转移5 mol电子,2.13 g氯气的物质的量为0.03 mol,转移电子为0.05 mol,故D正确;
答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成,d能使品红溶液褪色,e是液体,上述物质的转化关系如图所示(个别产物略去)。下列说法错误的是( )
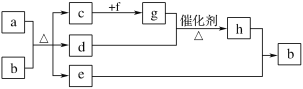
A.二元化合物沸点:e>d>c
B.简单氢化物的稳定性:Q>Y>X
C.元素的非金属性:Y>X>W
D.原子半径的大小:Z>Q>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的转化可储存太阳能,例如四环烷(QDC)与降冰片二烯(NBD)之间的相互转化,反应过程中的能量变化如图所示。

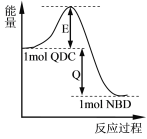
以下叙述中错误的是( )
A.QDC和NBD互为同分异构体
B.相同条件下,NBD比QDC稳定
C.QDC转变为NBD的过程中可以储存太阳能
D.上述转化过程中加入催化剂,对于图中Q的大小没有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C、D、E五种元素的核电荷数依次增大,A原子中p轨道电子数是s轨道电子数的一半;C、D同主族,且D的原子序数是C的2倍;E是第四周期ds区不活泼金属元素。根据以上信息用相应的元素符号填空:
(1)E+核外电子排布式为_______________,DC42-离子的空间构型为_____________________。
(2)ABC三元素第一电离能大小顺序为________________。
(3)D元素在周期表中的位置_______________,能导电的A单质与B、D、E的单质形成的晶体相比较,熔点由高到低的排列顺序是__________________(填化学式)。
(4)已知EDC4溶液中滴入氨基乙酸钠![]() 即可得到配合物G。其结构如图所示:
即可得到配合物G。其结构如图所示:
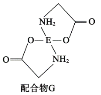
配合物G中碳原子的轨道杂化类型为_________________________________。
(5)(AB)2的电子式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成密蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:

相对分子质量 | 密度/(g·cm3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1 .0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:在A中加入4.4g异戊醇![]() 、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液洗涤;分出的产物再加入少量无水Na2SO4固体,静止片刻。过滤除去Na2SO4固体,讲行蒸馏纯化。收集140~143°C馏分,得到乙酸异戊酯3.9g。回答下列问题:
、6.0g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液洗涤;分出的产物再加入少量无水Na2SO4固体,静止片刻。过滤除去Na2SO4固体,讲行蒸馏纯化。收集140~143°C馏分,得到乙酸异戊酯3.9g。回答下列问题:
(1)实验中制备乙酸异戊酯的化学方程式为_________________。
(2)仪器B的名称是_______________,作用是____________。
(3)在洗涤操作中饱和碳酸氢钠溶液的主要作用是______________。
(4)实验中加入少量无水Na2SO4的目的是_________________________。
(5)实验中加过量乙酸的目的是___________________________。
(6)本实验的产率是_______________(填标号)。
a.30% b.40% c.50% d.60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种中学常见物质之间的转化关系如图所示(部分反应条件已省略)。已知:E为常见金属;在标准状况下气体R的密度为![]() 。下列推断合理的是( )
。下列推断合理的是( )
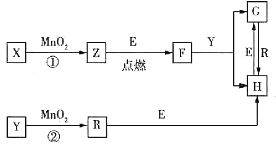
A.X—定是H2O2
B.![]() 在反应①②中都作催化剂
在反应①②中都作催化剂
C.常温下,![]() 溶液的pH=2
溶液的pH=2
D.上述转化涉及的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按要求填空
(1)5.4gH2O物质的量为____________mol,约含有___________________个原子;
(2)已知1.204×1023个X气体的质量是6.4g。则X气体的摩尔质量是_________ g/mol;
(3)同温同压下,同体积的甲烷CH4和CO2质量之比为________,质子数之比_______;
(4)VLAl2(SO4)3溶液中含Al3+ag,该Al2(SO4)3溶液的物质的量浓度为_____mol/L,取出![]() L再加入水稀释到4VL。则稀释后溶液中SO42-的物质的量浓度是_____mol/L。
L再加入水稀释到4VL。则稀释后溶液中SO42-的物质的量浓度是_____mol/L。
Ⅱ.按要求书写下列反应的方程式
(1)亚硫酸氢钠电离方程式(NaHSO3)________________________________________________;
(2)醋酸溶液与NaHCO3溶液反应的离子方程式为________________________________;
(3)0.8molL﹣1NaHSO4与0.4molL﹣1Ba(OH)2溶液等体积混合,反应的离子方程式为___________;
(4)黑火药爆炸的化学方程式为________________________________。
Ⅲ.请配平以下化学方程式
(1)____FeSO4+____K2O2+____H2O =____ Fe(OH) 3+____ Fe2(SO4) 3+____KOH
(2)_____BiO3-+_____Mn2++____=_____Bi3++_____ MnO4- +____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子共存的说法或离子方程式的书写中,正确的一组是( )
① 加入NaOH溶液后的溶液中能大量共存的离子:NH4+、Al3+、Cl-、SO42-
② pH=1的溶液中能大量共存的离子:Fe3+、Mg2+、Cl-、SO42-
③能使酚酞溶液变红的溶液中能大量共存的离子:K+、CO32-、Na+、S2-
④ 向NH4HCO3溶液中加入足量NaOH溶液并共热:NH4+ + OH— = NH3↑+ H2O
⑤ 用食醋溶解水垢:CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O
⑥ 向硫酸氢钠溶液中滴入氢氧化钡溶液至pH = 7:Ba2+ + 2OH— + 2H+ + SO42— = BaSO4↓ + 2H2O
⑦ 用FeCl3溶液腐蚀铜电路板:2Fe3+ + Cu= 2Fe2+ + Cu2+
A.①③⑤⑦B.②③⑥⑦C.②④⑤⑦D.③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CH3CH=CH2、NH3、O2为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的化学方程式分别为:反应Ⅰ.2C3H6+2NH3+3O2![]() 2C3H3N(g)+6H2O(g);反应Ⅱ.C3H6+O2
2C3H3N(g)+6H2O(g);反应Ⅱ.C3H6+O2![]() C3H4O(g)+H2O(g)。反应相同时间,丙烯腈产率与反应温度的关系如图a所示,丙烯腈和丙烯醛的平衡产率与
C3H4O(g)+H2O(g)。反应相同时间,丙烯腈产率与反应温度的关系如图a所示,丙烯腈和丙烯醛的平衡产率与![]() 的关系如图b所示。下列说法正确的是(丙烯腈的选择性=
的关系如图b所示。下列说法正确的是(丙烯腈的选择性=![]() ×100%)( )
×100%)( )
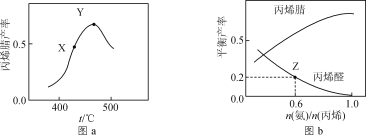
A.其他条件不变,增大压强有利于提高丙烯腈平衡产率
B.图a中X点所示条件下,延长反应时间能提高丙烯腈产率
C.图a中Y点所示条件下,改用对丙烯腈选择性更好的催化剂能提高丙烯腈产率
D.由图b中Z点可知,该温度下反应Ⅱ的平衡常数为K=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com