
【题目】已知热化学方程式:
SO2(g)+1/2O2(g)![]() SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是( )
A.烧碱、液态氧、碘酒
B.生石灰、白磷、熟石灰
C.干冰、铁、氯化氢
D.空气、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经一定时间后,可逆反应aA+bB![]() cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是
cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是
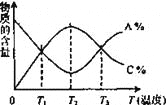
A. 该反应在T1、T3温度时达到化学平衡
B. 升高温度,平衡会向正反应方向移动
C. 该反应的逆反应是放热反应
D. 该反应在T2温度时达到化学平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂(用化学式表示),元素被氧化(用符号表示),HCl表现的性质是、 , 电子转移的数目是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关比较正确的是( )
A.N、O、F最高价依次升高
B.Al3+、S2-、F-微粒半径依次增大
C.单质的熔点:Cl2>Br2>I2
D.碱性:CsOH>KOH>NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
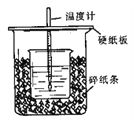
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________。
(2)烧杯间填满碎纸条的作用是________________。
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量________________(填“相等、不相等”),所求中和热___________(填“相等、不相等”)。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验, 测得的中和热的数值会________________。(填“偏大”、“偏小”、“无影响”)。
Ⅱ、(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________。

(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=___________。
(3)1.3gC2H2完全燃烧生成液态水和CO2,放出62kJ热量,写出C2H2燃烧的热化学方程式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 表示阿伏加德罗常数的值。下列说法正确的是
A. 在沸水中滴入含0.1molFeC13的饱和溶液,制得胶粒数为0.1 NA
B. 含0.4mol HNO3的稀硝酸与足量Fe反应,转移电子数为1.2 NA
C. 120 gNaHSO4和MgSO4的晶体混合物中阳离子数为NA
D. 标准状况下,44.8LSO2与足量O2反应生成的SO3分子数为2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com