
����Ŀ��������AIST������������һ�������������ͳɱ����-ͭ����ȼ�ϵ�ء��õ��ͨ��һ�ָ��ӵ�ͭ��ʴ���������������������зŵ����Ϊ2Li+Cu2O+H2O�T2Cu+2Li++2OH-������˵������ȷ����( )

A. �ŵ�ʱ��Li+������������Cu���ƶ�
B. �ŵ�ʱ�������ĵ缫��ӦʽΪCu2O+H2O+2e-=2Cu+2OH-
C. ͨ����ʱ��ͭ����ʴ���������Cu2O
D. ������Ӧ�����У�ͭ�൱�ڴ���
���𰸡�B
�����������������A����Ϊԭ��طŵ�ʱ����������������������Li+������������Cu���ƶ�����A��ȷ��B���õ��ͨ��һ�ָ��ӵ�ͭ��ʴ�������������ɷ���ʽ��֪ͭ�缫�ϲ���������ֱ�ӷŵ磬������ӦΪCu2O+H2O+2e-=Cu+2OH-����B����C���ŵ����Ϊ2Li+Cu2O+H2O�T2Cu+2Li++2OH-����֪ͨ����ʱ��ͭ����ʴ���������Cu2O����C��ȷ��D����C�����֪��ͭ����������Ӧ����Cu2O���ŵ�ʱCu2O��������Cu����������Ӧ�����У�ͭ�൱�ڴ�������D��ȷ����ѡB��


 ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��20����ĩ����ѧ�ҷ��ֺ��״��ڴ�����Ȼ��ˮ���ᄃ�塣����Ȼ��ˮ���ᄃ���У��м��顢������������̼�����⡢ϡ������ȣ�������ˮ���ᄃ������װ�ڼ���ˮ���ӹ��ɵ����ڣ�����ֳ�Ϊ��״�����
��1�����־���ͷǾ�����ɿ��Ŀ�ѧ������___________��
��2����̬Cԭ���У��������ռ�ݵ�����ܲ�ķ�����______�����ܲ�����ܼ����ӵĵ�����������״Ϊ________��
��3��H2S����������ԭ�ӵ��ӻ���ʽΪ_______��H2S��H-S-H�ļ��DZ�CH4��H-C-H�ļ���_______(����������С�����������)��
��4��CH4��CO2��H2O�γɵ���״�ṹ��ͼ��ʾ������ز������±���CH4��H2O�γɵ�ˮ���ᄃ���׳�����ȼ������
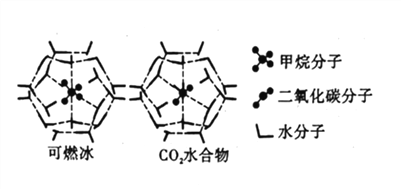
���� | ����ֱ��(nm) | ������H2O�Ľ����(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
�١���ȼ�����д��ڵ���������_____________��
��Ϊ�������������ȼ�������п�ѧ�������CO2�û�CH4�����롣��֪��ͼ����״�ṹ�Ŀ�ǻֱ��Ϊ0.586nm,��������ͼ���������������������_____________��
��5����֪ϡ�����廯����XeF2�Ŀռ乹����ͼ��ʾ���ݴ��ж�����ԭ��Xe���ӻ���ʽΪ_______(�����)��
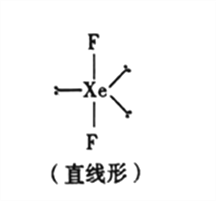
A.sp�ӻ� B.sp2�ӻ� C.sp3�ӻ� D.sp3d�ӻ�
��6�������ľ���ṹ��CO2���ƣ�����������һ������Ϊ���ģ�����Χ��_____�����ڵķ��ӣ������ڵ���������֮�����Ϊanm,��ʽ��ʾ����������ܶ�Ϊ______g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��װ���У���ͨ��ֱ����5 minʱ��ͭ�缫��������2.16 g��
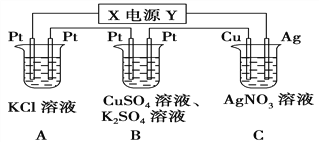
��1����Դ�缫X������Ϊ________��
��2��A�з��������ӷ���ʽΪ_______________________
��3��B�������ĵ缫��ӦʽΪ___________________________
��4��pH�仯��A_______��B_______��C_______��(��������������С������������)
��5��ͨ��5 min��B�й��ռ�224 mL����(��״��)����Һ���Ϊ200 mL����ͨ��ǰCuSO4��Һ�����ʵ���Ũ��Ϊ______________(����ǰ����Һ����ޱ仯)��
��6����A��KCl��Һ�����Ҳ��200 mL��������Һ��pHΪ_______(����ǰ����Һ����ޱ仯)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO2��NO��CO��NO2-���dz���������Ⱦ���ˮ��Ⱦ��о�NO2��NO��CO��NO2-�ȵĴ����Խ��������й�������Ҫ���塣
��֪:��NO2+CO![]() CO2+NO���÷�Ӧ��ƽ�ⳣ��ΪK1(��ͬ)���Ͽ�1mol�������ʵ����л�ѧ��ʱ�����������ֱ�Ϊ:
CO2+NO���÷�Ӧ��ƽ�ⳣ��ΪK1(��ͬ)���Ͽ�1mol�������ʵ����л�ѧ��ʱ�����������ֱ�Ϊ:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
��![]() N2(g)+
N2(g)+ ![]() O2(g)
O2(g)![]() NO(g) ��H=+89.75kJ/mol,K2
NO(g) ��H=+89.75kJ/mol,K2
��2NO(g)+O2(g)![]() 2NO2(g) ��H=-112.3kJ/mol,K3
2NO2(g) ��H=-112.3kJ/mol,K3
д��NO��CO��Ӧ��������Ⱦ������Ȼ�ѧ����ʽ:_____________�����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=_______(��K1��K2��K3��ʾ)
��2����Ⱦ������NO2��CO��һ�������µķ�ӦΪ2NO2+4CO![]() 4CO2+N2��ij�¶��£���1L�ܱ������г���0.1molNO2��0.2molCO,��ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ�⣬������ѹǿ��Ϊԭ����
4CO2+N2��ij�¶��£���1L�ܱ������г���0.1molNO2��0.2molCO,��ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ�⣬������ѹǿ��Ϊԭ����![]() ����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=_______�������¶��£�ijʱ�����NO2��CO��CO2��N2��Ũ�ȷֱ�Ϊamol/L��0.4mol/L��0.1mol/L��1mol/L,Ҫʹ��Ӧ���淴Ӧ������У�a��ȡֵ��ΧΪ________��
����Ӧ��ʼ��ƽ��ʱCO��ƽ����Ӧ����v(CO)=_______�������¶��£�ijʱ�����NO2��CO��CO2��N2��Ũ�ȷֱ�Ϊamol/L��0.4mol/L��0.1mol/L��1mol/L,Ҫʹ��Ӧ���淴Ӧ������У�a��ȡֵ��ΧΪ________��
��3���о�����:NOx����������Ҫ�ɷ�֮һ��NH3����ԭ��������(SCR)������ĿǰӦ����㷺���������������ѳ���������֪:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ��H=-1810kJ/mol
����ͬ�����£���2L�����ܱ������У�ѡ�ò�ͬ�Ĵ�����������Ӧ����N2�����ʵ�����ʱ��仯�������ͼ��ʾ��
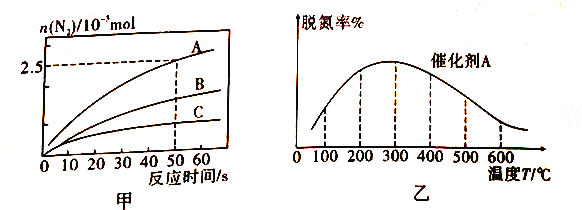
a.�ڴ���A�����£���Ӧ�ﵽƽ��ı�־��_____(�����)��
A.4v(NH3)��=6v(H2O)��
B.��������ѹǿ���ٸı�
C.�������ܶȲ��ٸı�
D.NO ��H2O(g)Ũ�����
E.������ƽ��Ħ���������ٸı�
b.��A��B��C ���ִ����£�����������ﷴӦ�Ļ�ֱܷ��ʾΪEa(A)��Ea(B)��Ea(C)������ͼ����ʾ���ߣ��ж����ִ��������£�����ɴ�С��˳��Ϊ________��
���ڰ�������ʱ����Ӧ�ڴ���A �����£�������ͬʱ�䣬����ѵ���ֳ��Ӧ�¶ȵı仯�����ͼ����ʾ����ͼ��֪������ͬ��ʱ���ڣ��¶ȶ��ѵ��ʵ�Ӱ�켰������ԭ����________��(��֪A��B�����ڴ��¶ȷ�Χ�ڲ�ʧЧ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȵ�����2%ת��Ϊ�����Լ�ǿ�ġ��������������ܼ�������˥�ϣ�����Ϊ������ɱ�֡������ú���Ԫ�أ�Se���Ļ������������ƣ�Na2SeO3��������������ȵĻ��������ɴ��ƶ�Na2SeO3�������ǣ� ��
A.����ԭ��
B.��������
C.����������������ԭ��
D.�Ȳ����������ֲ�����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ҹ�����Դ�����У�������Ҫ��ս�Խ�����Դ����������ij��������Ҫ�ɷ�ΪCr2O3��������Ҫ��FeO��SiO2�ȣ�Ϊԭ������Cr2O3�Ĺ������̣�
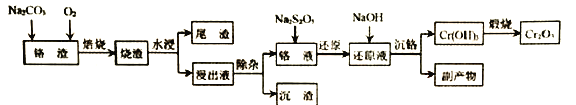
��֪��Ksp[Mg(OH)2]��1.2��10��11��Ksp [Cr(OH)3]��6.4��10��31
��1��������������ʽ��ʾ�������ɣ�Fe2SiO4�ɱ�ʾΪ______��
��2������ʱͨ�������������� ______��
��3�������ӡ�ʱ����MgSO4-(NH4)2SO4���������Һ��������PO43�� ��AsO43�� ��SiO32����Ӧ���ֱ�ת��ΪNH4MgPO4��NH4MgAsO4��MgSiO3������ȥ��
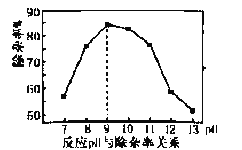
�ٷ�Ӧ���̿�����ҺpHΪ9����pH��9�����ʽ��͵�ԭ���� ______��
�ڷ�Ӧ���¶ȿ�����80�����ң��¶Ȳ���̫�ߵ���Ҫԭ����_______��
��4������ԭ��ʱ�ȵ�����ҺpH���ټ��뽹�������ƣ�Na2S2O5��
����ɡ���ԭ����Ӧ�����ӷ���ʽ��_____________
![]()
����֪��Һ��c(Cr2O72�� )��0.32 mol/L ��Ϊ�˲�ʹ��ԭ���̲���Cr(OH)3������Ӧ ���Ʒ�Ӧ����pH������ _____��
��5������������Ҫ������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ૣ�DHP���������л��ϳ��еı�������
��1����������·�߿����Ƶ�DHP��

�ٵ���A�ķ���ʽΪ_____�� DHP���ӵĺ˴Ź���������_____��塣
��1mol��ȩ��3mol H2��Ӧת��ΪB����B�Ľṹ��ʽΪ_____��
�� DHP��ͬ���칹���У�������״�л������ܷ���������Ӧ����_____�֡�
��2����֪��i. DHP�ı������ѱ�������Ϊ
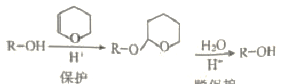
ii. R��C��CNa + R1OH �� R��C��CH + R1ONa
iii. R��C��CNa + R1Br �� R��C��C��R1+ NaBr
Ӧ��DHP���������ϳ���Сʳ�ij����⼤�ص�·��������
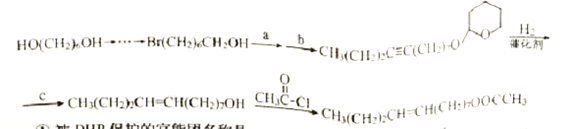
�ٱ�DHP�����Ĺ�����������_______��������Ӧ�������� ______��
������·�������һ����Ӧ�ķ���ʽΪ ______��
������·���в���a��b��c�ֱ�Ϊ_______�� ______��_______��������  ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�и�����Ũ�ȹ�ϵ��ȷ���ǣ� ��
A. 0.1mol��L-1Na2S��Һ�У�2[Na+]=[S2-]+[HS-]+[H2S]
B. 0.1mol��L-1NaHSO4��Һ�У�[Na+]>[SO42-]>[H+]>[OH-]
C. Na2C2O4��Һ��c(OH-)=c(H+)+c(HC2O4)+2c(H2C2O4)
D. CH3COONa��CaCl2�����Һ��c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ȼ�ѧ����ʽ��
SO2��g����1/2O2��g��![]() SO3��g����H����98��32 kJ/mol���������г���2 mol SO2��1 mol O2��ַ�Ӧ�����շų�������Ϊ
SO3��g����H����98��32 kJ/mol���������г���2 mol SO2��1 mol O2��ַ�Ӧ�����շų�������Ϊ
A. 196��64 kJ B. 196��64 kJ/mol C. ��196��64 kJ D. ��196��64 kJ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com