
【题目】吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素(Se)的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是( )
A.作还原剂
B.作氧化剂
C.既作氧化剂又作还原剂
D.既不作氧化剂又不作还原剂
科目:高中化学 来源: 题型:
【题目】CO可用于合成甲醇,下图是反应CO(g)+2H2(g)![]() CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH________0(填“>”“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1________K2(填“>”、“<”或“=”)。
③在T1温度下,往体积为1 L的密闭容器中,充入1 mol CO和2 mol H2 ,经测得CO和CH3OH(g)的浓度随时间变化如下图所示。则该反应的平衡常数为______________。
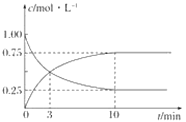
④若容器容积不变,下列措施可增加CO转化率的是________(填字母)。
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He,使体系总压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,温度不变时将某容器分隔成A,B两部分,A、B之间的挡板可以左右自由移动,B有可移动的活塞,在A中充入2molSO2和1molO2,平衡时A的体移变为原体积的0.7倍;在B中充入2molSO3和1molN2,在相同温度和任强条件下发生反应,也建立平衡。下列说法正确的是
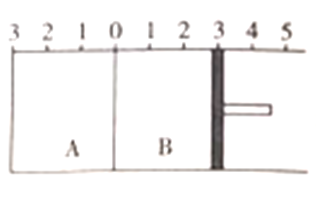
A. 平衡后A、B两容器的体积比大于2.1:3.1
B. 平衡后B容器中SO2的体积分数小于2/21
C. 平衡后B容器中SO3的转化率小于10%
D. 平衡后A、B两容器中S02的物质的量为A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.只含有一种元素的物质一定是纯净物
B.含有共价键的化合物一定是共价化合物
C.石墨转变为金刚石为化学变化
D.水很稳定是因为水分子间存在较强的分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1869年门捷列夫制作第一张周期表的根据是依据原子序数,这在当时有重要意义。
B.周期表中有七个主族,八个副族,一个0族。18个纵行,共16个族。
C.短周期元素是指1~20号元素。
D.周期表中有七个周期。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂(Pt)及其化合物用途广泛。
(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于 ______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
(2)二氯二吡啶合铂是由Pt2+ 、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同 分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的外围电子排布式为 ______。
②吡啶分子是大体积平面配体,其结构简式如右图所示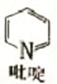 ,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是 ___、____,各元素的电负性由大到小的顺序为_______。
,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是 ___、____,各元素的电负性由大到小的顺序为_______。
③二氯二吡啶合铂分子中存在的微粒间作用力有 _____(填序号)。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由: ________。
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是 _____分子(选填“极性”、“非极性”)。
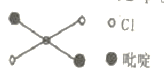
(3)金属铂立方晶胞沿 x、y或z轴的投影图如右图所示。若金属铂的密度为d g·cm-3,则晶胞参数a=_____nm(列出计算式即可)。
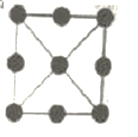
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。
(1)已知在101 kPa时,32.0 g N2H4在氧气中完全燃烧生成氮气和水,放出热量624 kJ(25 ℃时),N2H4完全燃烧的热化学方程式是__________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时,正极的反应式是___________________________;负极的反应式是____________________________。
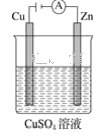
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应式是_________________________________________________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气______L(假设空气中氧气体积分数为20%)。
(4)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?________(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】经一定时间后,可逆反应aA+bB![]() cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是
cC中物质的含量A%和C%随温度的变化曲线如下图所示,下列说法正确的是
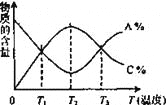
A. 该反应在T1、T3温度时达到化学平衡
B. 升高温度,平衡会向正反应方向移动
C. 该反应的逆反应是放热反应
D. 该反应在T2温度时达到化学平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com