
【题目】二氢吡喃(DHP)常用作有机合成中的保护基。
(1)按照如下路线可以制得DHP。

①单糖A的分子式为_____, DHP分子的核磁共振氢谱有_____组峰。
②1mol糠醛与3mol H2反应转化为B,则B的结构简式为_____。
③ DHP的同分异构体中,属于链状有机物且能发生银镜反应的有_____种。
(2)已知:i. DHP的保护和脱保护机理为
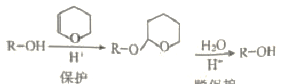
ii. R-C≡CNa + R1OH → R-C≡CH + R1ONa
iii. R-C≡CNa + R1Br → R-C≡C-R1+ NaBr
应用DHP作保护基合成梨小食心虫性外激素的路线如下:
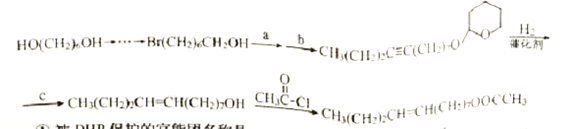
①被DHP保护的官能团名称是_______,保护反应的类型是 ______。
②上述路线中最后一步反应的方程式为 ______。
③上述路线中步骤a、b、c分别为_______、 ______、_______。(例:  )
)
【答案】 C5H10O5 5 ![]() 8 羟基 加成反应 HO(CH2)7CH=CH(CH2)2CH3 +CH3COCl→CH3COO(CH2)7CH=CH(CH2)2CH3+HCl
8 羟基 加成反应 HO(CH2)7CH=CH(CH2)2CH3 +CH3COCl→CH3COO(CH2)7CH=CH(CH2)2CH3+HCl 
![]()
【解析】(1). ①.单糖A失去3分子水生成糠醛,糠醛的分子式为C5H4O2,所以单糖A的分子式为C5H10O5,由DHP的结构简式可知,DHP分子中含有5种化学环境不同的氢原子,则DHP分子的核磁共振氢谱有5组峰,故答案为:C5H10O5;5;
②. 糠醛分子中含有2个碳碳双键和1个醛基,1mol糠醛与3mol H2发生加成反应生成B,B的结构简式为:![]() ,故答案为:
,故答案为:![]() ;
;
③. DHP的分子式为C5H8O,属于链状有机物且能发生银镜反应,结合DHP的分子式,说明含有1个醛基和1个碳碳双键,把醛基看成取代基,剩余的4个碳原子的连接方式有:C=C-C-C、C-C=C-C、![]() ,将醛基作为取代基连接在C原子上,C=C-C-C有4种连接方式,C-C=C-C有2种连接方式,
,将醛基作为取代基连接在C原子上,C=C-C-C有4种连接方式,C-C=C-C有2种连接方式,![]() 有2中连接方式,共8种,故答案为:8;
有2中连接方式,共8种,故答案为:8;
(2). ①. 由DHP的保护和脱保护机理可知,醇与DHP发生加成反应,最后脱水再生成醇,所以被DHP保护的官能团是羟基,故答案为:羟基;加成反应;
②. HO(CH2)7CH=CH(CH2)2CH3与CH3COCl发生取代反应生成CH3COO(CH2)7CH=CH(CH2)2CH3和HCl,反应方程式为:HO(CH2)7CH=CH(CH2)2CH3 +CH3COCl→CH3COO(CH2)7CH=CH(CH2)2CH3+HCl,故答案为:HO(CH2)7CH=CH(CH2)2CH3 +CH3COCl→CH3COO(CH2)7CH=CH(CH2)2CH3+HCl;
③.由DHP的保护和脱保护机理及梨小食心虫性外激素的合成路线可知,Br(CH2)6CH2OH与DHP在酸性条件下生成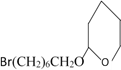 ,
, 与NaC≡C(CH2)2CH3反应生成
与NaC≡C(CH2)2CH3反应生成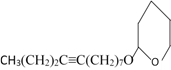 ,
,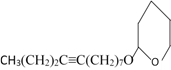 与氢气发生加成反应生成
与氢气发生加成反应生成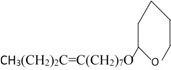 ,
,在酸性条件下与水反应生成CH3(CH2)2 CH=CH(CH2)7OH,故答案为:
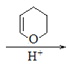 ;
;![]() ;
; 。
。


科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
(1)配制100mL0.100molL-1 NaOH标准溶液。
① 主要操作步骤:计算→称量→溶解→_______(冷却后)→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
② 称量_____g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、________、烧杯(或表面皿)。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用配制的标准NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.100 | 22.18 | 20.00 |
2 | 0.100 | 22.22 | 20.00 |
3 | 0.100 | 22.20 | 20.00 |
①该实验滴定达到终点的标志是_____________________________。
②根据上述数据,可计算出该盐酸的浓度约为_________________(保留三位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH固体时,混入少量KOH杂质
④现用以上实验配制的0.10 molL-1NaOH溶液测定食醋中乙酸的浓度,应该选用的指示剂为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.只含有一种元素的物质一定是纯净物
B.含有共价键的化合物一定是共价化合物
C.石墨转变为金刚石为化学变化
D.水很稳定是因为水分子间存在较强的分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”锂-铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法不正确的是( )

A. 放电时,Li+透过固体电解质向Cu极移动
B. 放电时,负极的电极反应式为Cu2O+H2O+2e-=2Cu+2OH-
C. 通空气时,铜被腐蚀,表面产生Cu2O
D. 整个反应过程中,铜相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铂(Pt)及其化合物用途广泛。
(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于 ______。
A.s区 B.p区 C.d区 D.ds 区 E.f区
(2)二氯二吡啶合铂是由Pt2+ 、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同 分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的外围电子排布式为 ______。
②吡啶分子是大体积平面配体,其结构简式如右图所示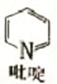 ,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是 ___、____,各元素的电负性由大到小的顺序为_______。
,该配体的配位原子是_____。吡啶分子中,碳、氮原子的轨道杂化方式分别是 ___、____,各元素的电负性由大到小的顺序为_______。
③二氯二吡啶合铂分子中存在的微粒间作用力有 _____(填序号)。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由: ________。
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是 _____分子(选填“极性”、“非极性”)。
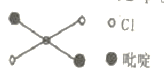
(3)金属铂立方晶胞沿 x、y或z轴的投影图如右图所示。若金属铂的密度为d g·cm-3,则晶胞参数a=_____nm(列出计算式即可)。
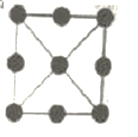
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480mL 0.5mol·L-1 NaOH溶液以备使用。
(1).该同学应选择__________mL的容量瓶。
(1).其操作步骤如乙图所示,则甲图操作应在乙图中的__________(填选项字母)之间。
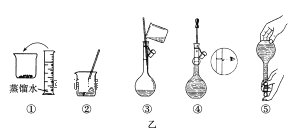
A.②与③B.①与②C.③与④
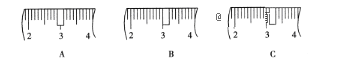
(1). 该同学应称取NaOH固体__________g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小__________(填字母),并在如图中选出能正确表示游码位置的选项__________(填字母)。
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。
(1)已知在101 kPa时,32.0 g N2H4在氧气中完全燃烧生成氮气和水,放出热量624 kJ(25 ℃时),N2H4完全燃烧的热化学方程式是__________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时,正极的反应式是___________________________;负极的反应式是____________________________。
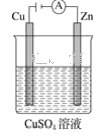
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应式是_________________________________________________。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气______L(假设空气中氧气体积分数为20%)。
(4)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?________(填“是”或“否”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关比较正确的是( )
A.N、O、F最高价依次升高
B.Al3+、S2-、F-微粒半径依次增大
C.单质的熔点:Cl2>Br2>I2
D.碱性:CsOH>KOH>NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com