
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
(1)配制100mL0.100molL-1 NaOH标准溶液。
① 主要操作步骤:计算→称量→溶解→_______(冷却后)→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
② 称量_____g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、________、烧杯(或表面皿)。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用配制的标准NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.100 | 22.18 | 20.00 |
2 | 0.100 | 22.22 | 20.00 |
3 | 0.100 | 22.20 | 20.00 |
①该实验滴定达到终点的标志是_____________________________。
②根据上述数据,可计算出该盐酸的浓度约为_________________(保留三位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH固体时,混入少量KOH杂质
④现用以上实验配制的0.10 molL-1NaOH溶液测定食醋中乙酸的浓度,应该选用的指示剂为_______。
【答案】 转移 0.4 药匙 最后一滴NaOH溶液加入时,溶液由无色恰好变成浅红色并且在半分钟内不褪色 0.11 molL-1 DE 酚酞
【解析】(1)①配制100mL 0.100mol/L NaOH标准溶液的步骤为:计算→称量→溶解→(冷却后)转移→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。故答案为:转移;
②需要的NaOH的m=nM=cVM=0.1L×0.10molL-1×40g/mol=0.4g;称量0.4gNaOH固体需仪器天平(带砝码、镊子),NaOH具有腐蚀性,应该放在烧杯或表面皿中称量,还需要取NaOH的仪器药匙;
故答案为:0.4;药匙;
(2)①锥形瓶中滴有酚酞指示剂,滴定结束前溶液为无色,滴定结束时氢氧化钠过量,溶液变成红色,所以滴定终点现象为:最后一滴NaOH溶液加入时,溶液由无色恰好变成浅红色并且在半分钟内不褪色;
②三次滴定数据都有效,消耗标准液的平均体积为: ![]() mL=22.20mL,
mL=22.20mL,
该盐酸的浓度为:c(HCl)= ![]() =
=![]() ≈0.11mol/L;
≈0.11mol/L;
③根据c(HCl)= ![]() 分析,若V(NaOH)偏小,则待测液浓度c(HCl)偏小;若V(NaOH)偏大,则待测液浓度c(HCl)偏大。A、滴定终点时俯视读数,造成V(NaOH)偏小,所以c(HCl)偏小,故A错误;B、酸式滴定管使用前,未用待测盐酸润洗,待测液被稀释,造成n(HCl)偏小,所以滴定过程中消耗的V(NaOH)偏小,则c(HCl)偏小,故B错误;C、锥形瓶未干燥,待测液的物质的量不变,对V(NaOH)无影响,c(HCl)无影响,故C错误;D、滴定前滴定管尖嘴处有气泡,滴定后气泡消失,造成V(NaOH)偏大,c(HCl)偏大,故D正确;E、称量NaOH时混入少量KOH杂质,由于KOH摩尔质量大于NaOH,所以称取的一定质量的固体中n(OH-)偏小,所配制的NaOH溶液,c(OH-)偏小,滴定时实际消耗的标准液体积偏大,所以所得待测液浓度c(HCl)偏大,故E正确。故选DE。
分析,若V(NaOH)偏小,则待测液浓度c(HCl)偏小;若V(NaOH)偏大,则待测液浓度c(HCl)偏大。A、滴定终点时俯视读数,造成V(NaOH)偏小,所以c(HCl)偏小,故A错误;B、酸式滴定管使用前,未用待测盐酸润洗,待测液被稀释,造成n(HCl)偏小,所以滴定过程中消耗的V(NaOH)偏小,则c(HCl)偏小,故B错误;C、锥形瓶未干燥,待测液的物质的量不变,对V(NaOH)无影响,c(HCl)无影响,故C错误;D、滴定前滴定管尖嘴处有气泡,滴定后气泡消失,造成V(NaOH)偏大,c(HCl)偏大,故D正确;E、称量NaOH时混入少量KOH杂质,由于KOH摩尔质量大于NaOH,所以称取的一定质量的固体中n(OH-)偏小,所配制的NaOH溶液,c(OH-)偏小,滴定时实际消耗的标准液体积偏大,所以所得待测液浓度c(HCl)偏大,故E正确。故选DE。
④用NaOH溶液滴定乙酸,滴定终点时,溶液呈碱性,所以应该选用酚酞作指示剂。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】(1)硅和氯两元素的单质反应生成1 mol Si的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为-69 ℃和58 ℃,写出该反应的热化学方程式__________________________________________。
(2)比较下列溶液中指定微粒浓度的大小:浓度均为0.1 mol·L-1的①H2S、②NaHS、③Na2S、④H2S和NaHS混合液,溶液pH从大到小的顺序是_____________。(填序号)c(H2S)从大到小的顺序是__________。(填序号)
(3)已知Ksp[Cu(OH)2] = 1×10-20 。要使0.2 mol / L 的CuSO4溶液中Cu2+沉淀较为完全,则应向溶液里加入NaOH溶液,调整溶液的pH范围为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20世纪末,科学家发现海底存在大量天然气水合物晶体。在天然气水合物晶体中,有甲烷、氧气、二氧化碳、硫化氢、稀有气体等,它们在水合物晶体里是装在几个水分子构成的笼内,因而又称为笼状化合物。
(1)区分晶体和非晶体最可靠的科学方法是___________。
(2)基态C原子中,核外电子占据的最高能层的符号是______,该能层最高能级电子的电子云轮廓形状为________。
(3)H2S分子中中心原子的杂化方式为_______。H2S中H-S-H的键角比CH4中H-C-H的键角_______(填“大”“小”或“相等”)。
(4)CH4、CO2与H2O形成的笼状结构如图所示,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
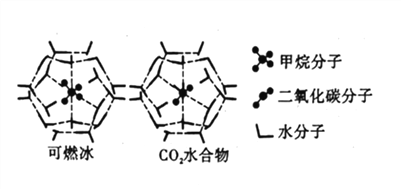
物质 | 分子直径(nm) | 分子与H2O的结合能(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中存在的作用力有_____________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表分析,该设想的依据是_____________。
(5)已知稀有气体化合物XeF2的空间构型如图所示,据此判断中心原子Xe的杂化方式为_______(填序号)。
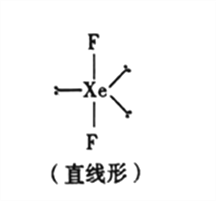
A.sp杂化 B.sp2杂化 C.sp3杂化 D.sp3d杂化
(6)氧气的晶体结构与CO2相似,晶体中若以一个分子为中心,其周围有_____个紧邻的分子,若紧邻的两个分子之间距离为anm,列式表示氧气晶体的密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向x mL 0.01 mol·L-1氨水中滴加等物质的量浓度的H2SO4溶液,测得混合溶液的pOH[pOH= -lgc(OH-)]、温度随着加入的硫酸溶液体积的变化如图所示,下列说法正确的是( )。
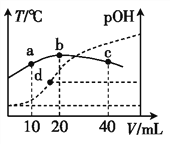
A. x=20
B. b点时溶液的pOH=pH
C. c点对应的溶液中:c(S![]() )>c(N
)>c(N![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
D. a、b、d三点NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存的是( )
A.K+、Cl-、CO32-、Ca2+B.H+、Fe2+、NO3-、Na+
C.Na+、NH4+、Cl-、NO3-D.NH4+、SO42-、K+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、生产和社会发展密切相关。下列说法正确的是
A. 《天工开物》中“凡石灰,经火焚炼而用”里的石灰,指的是Ca(OH)2
B. 某品牌的八宝粥不含任何糖类物质,糖尿病人可以放心食用
C. 未成熟的苹果肉遇碘酒变蓝,成熟苹果的汁液不能与银氨溶液反应
D. 用氯化铁溶液洗涤银镜反应后的试管比用硫酸铁溶液效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g。
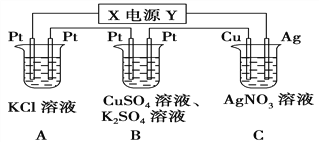
(1)电源电极X的名称为________;
(2)A中发生的离子方程式为_______________________
(3)B中阳极的电极反应式为___________________________
(4)pH变化:A_______,B_______,C_______。(填“增大”“减小”或“不变”)
(5)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为______________(设电解前后溶液体积无变化)。
(6)若A中KCl溶液的体积也是200 mL,电解后,溶液的pH为_______(设电解前后溶液体积无变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氢吡喃(DHP)常用作有机合成中的保护基。
(1)按照如下路线可以制得DHP。

①单糖A的分子式为_____, DHP分子的核磁共振氢谱有_____组峰。
②1mol糠醛与3mol H2反应转化为B,则B的结构简式为_____。
③ DHP的同分异构体中,属于链状有机物且能发生银镜反应的有_____种。
(2)已知:i. DHP的保护和脱保护机理为
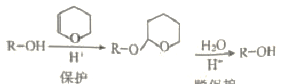
ii. R-C≡CNa + R1OH → R-C≡CH + R1ONa
iii. R-C≡CNa + R1Br → R-C≡C-R1+ NaBr
应用DHP作保护基合成梨小食心虫性外激素的路线如下:
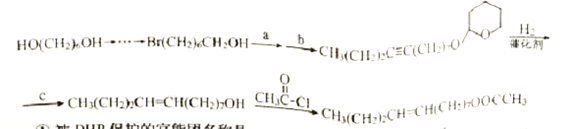
①被DHP保护的官能团名称是_______,保护反应的类型是 ______。
②上述路线中最后一步反应的方程式为 ______。
③上述路线中步骤a、b、c分别为_______、 ______、_______。(例:  )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com