
【题目】某同学帮助水质检测站配制480mL 0.5mol·L-1 NaOH溶液以备使用。
(1).该同学应选择__________mL的容量瓶。
(1).其操作步骤如乙图所示,则甲图操作应在乙图中的__________(填选项字母)之间。
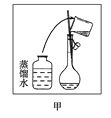
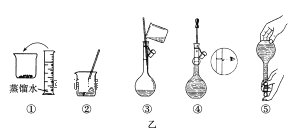
A.②与③B.①与②C.③与④
(1). 该同学应称取NaOH固体__________g,用质量为23.1g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小__________(填字母),并在如图中选出能正确表示游码位置的选项__________(填字母)。
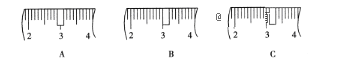
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能大量共存的是( )
A.K+、Cl-、CO32-、Ca2+B.H+、Fe2+、NO3-、Na+
C.Na+、NH4+、Cl-、NO3-D.NH4+、SO42-、K+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、NO、CO、NO2-等是常见大气污染物和水污染物,研究NO2、NO、CO、NO2-等的处理对建设美丽中国具有重要意义。
已知:①NO2+CO![]() CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
CO2+NO,该反应的平衡常数为K1(下同)。断开1mol下列物质的所有化学键时所消耗能量分别为:
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②![]() N2(g)+
N2(g)+ ![]() O2(g)
O2(g)![]() NO(g) △H=+89.75kJ/mol,K2
NO(g) △H=+89.75kJ/mol,K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol,K3
2NO2(g) △H=-112.3kJ/mol,K3
写出NO与CO反应生成无污染气体的热化学方程式:_____________,此热化学方程式的平衡常数K=_______(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
,则反应开始到平衡时CO的平均反应速率v(CO)=_______。若此温度下,某时刻则得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围为________。
(3)研究发现:NOx是雾霾的主要成分之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。已知:4NH3(g)+6NO(g)=5N2(g)+6H2O(g) △H=-1810kJ/mol
①相同条件下,在2L恒容密闭容器中,选用不同的催化剂,上述反应产生N2的物质的量随时间变化的情况如图所示。
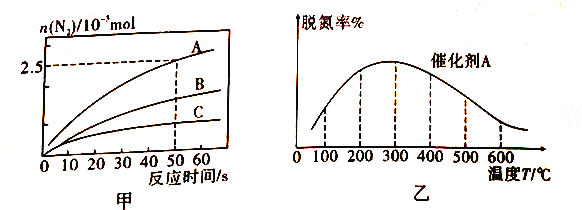
a.在催化剂A作用下,反应达到平衡的标志是_____(填序号)。
A.4v(NH3)正=6v(H2O)逆
B.容器内总压强不再改变
C.容器内密度不再改变
D.NO 和H2O(g)浓度相等
E.容器内平均摩尔质量不再改变
b.在A、B,C 三种催化剂下,清除氮氧化物反应的活化能分别表示为Ea(A)、Ea(B)、Ea(C),根据图甲所示曲线,判断三种催化剂条件下,活化能由大到小的顺序为________。
②在氨气足量时,反应在催化剂A 作用下,经过相同时间,测得脱氮潮殖反应温度的变化情况如图乙所示,据图可知,自相同的时间内,温度对脱氮率的影响及可他的原因是________。(已知A、B催化剂在此温度范围内不失效)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在我国的资源储备中,铬是重要的战略金属资源。以下是以某铬渣(主要成分为Cr2O3,杂质主要是FeO、SiO2等)为原料生产Cr2O3的工艺流程:
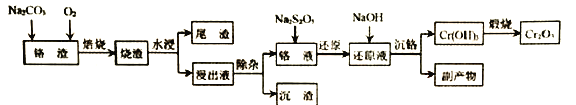
已知:Ksp[Mg(OH)2]=1.2×10-11,Ksp [Cr(OH)3]=6.4×10-31
(1)若以氧化物形式表示矿物的组成,Fe2SiO4可表示为______。
(2)焙烧时通入氧气的作用是 ______。
(3)“除杂”时加入MgSO4-(NH4)2SO4混合物与溶液中少量的PO43- 、AsO43- 、SiO32-反应,分别转化为NH4MgPO4、NH4MgAsO4、MgSiO3沉淀除去。
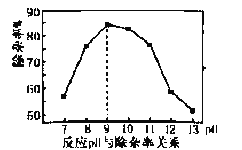
①反应过程控制溶液pH为9,若pH>9除杂率降低的原因是 ______。
②反应的温度控制在80℃左右,温度不宜太高的主要原因是_______。
(4)“还原”时先调节溶液pH,再加入焦亚硫酸钠(Na2S2O5)
①完成“还原”反应的离子方程式:_____________
![]()
②已知铬液中c(Cr2O72- )=0.32 mol/L ,为了不使还原过程产生Cr(OH)3沉淀,应 控制反应过程pH不大于 _____。
(5)“沉铬”主要副产物为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
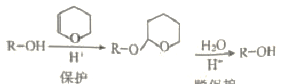
【题目】二氢吡喃(DHP)常用作有机合成中的保护基。
(1)按照如下路线可以制得DHP。

①单糖A的分子式为_____, DHP分子的核磁共振氢谱有_____组峰。
②1mol糠醛与3mol H2反应转化为B,则B的结构简式为_____。
③ DHP的同分异构体中,属于链状有机物且能发生银镜反应的有_____种。
(2)已知:i. DHP的保护和脱保护机理为
ii. R-C≡CNa + R1OH → R-C≡CH + R1ONa
iii. R-C≡CNa + R1Br → R-C≡C-R1+ NaBr
应用DHP作保护基合成梨小食心虫性外激素的路线如下:
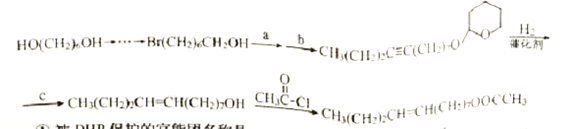
①被DHP保护的官能团名称是_______,保护反应的类型是 ______。
②上述路线中最后一步反应的方程式为 ______。
③上述路线中步骤a、b、c分别为_______、 ______、_______。(例:  )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X可能是由Na2SiO3、Fe、Na2CO3、 BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)。

下列说法不正确的是:
A. 气体A一定是混合气体
B. 沉淀A一定是H2SiO3
C. 白色沉淀B在空气中逐渐变灰绿色,最后变红褐色
D. 该固体混合物一定含有Fe、Na2CO3、BaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A. 0.1mol·L-1Na2S溶液中:2[Na+]=[S2-]+[HS-]+[H2S]
B. 0.1mol·L-1NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-]
C. Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4)+2c(H2C2O4)
D. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在恒容密闭容器中发生如下反应:2M(g)+N(g)![]() 2E(g),若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为
2E(g),若开始时只充入2molE(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2molM和1molN的混合气体,达平衡时M的转化率为
A. 20% B. 40% C. 60% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下图所示实验装置的 K 闭合,下列判断正确的是

A. Cu电极上发生还原反应 B. 电子沿 Zn→a→b→Cu路径流动
C. 片刻后甲池中c(SO![]() )增大 D. 片刻后可观察到滤纸b点变红色
)增大 D. 片刻后可观察到滤纸b点变红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com