
【题目】Ⅰ、用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
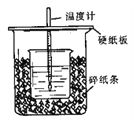
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________________。
(2)烧杯间填满碎纸条的作用是________________。
(3)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量________________(填“相等、不相等”),所求中和热___________(填“相等、不相等”)。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验, 测得的中和热的数值会________________。(填“偏大”、“偏小”、“无影响”)。
Ⅱ、(1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________。

(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=___________。
(3)1.3gC2H2完全燃烧生成液态水和CO2,放出62kJ热量,写出C2H2燃烧的热化学方程式:_______________________________________________。
【答案】 环形玻璃搅拌棒 减少实验过程中的热量损失 不相等 相等 偏小 NO2(g) + CO(g) = CO2(g) + NO(g) △H=-234kJ/mol △H=+226.7 kJ/mol 2C2H2(g)+5O2(g) == 4CO2(g)+2H2O(l) ΔH= -2480 kJ/mol
【解析】试题分析:Ⅰ、(1)根据量热计的构造分析;(2)中和热测定实验成败的关键是防止热量散失;(3)反应放出的热量和所用酸以及碱的量的多少有关;中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关。(4)氨水为弱碱,电离过程吸热;Ⅱ、(1)焓变=生成物的总能量-反应物的总能量;(2)根据盖斯定律计算C(s,石墨)和H2(g)生成1mol C2H2(g)的焓变;(3)1.3gC2H2完全燃烧生成液态水和CO2,放出62kJ热量,则2molC2H2完全燃烧生成液态水和CO2,放出2480 kJ热量。
解析:Ⅰ、(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器;(2)中和热测定实验成败的关键是防止热量散失,烧杯间填满碎纸条的作用是减少实验过程中的热量损失;(3)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25molL-1H2SO4溶液跟50mL0.55molL-1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量不相等;中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以所求中和热数值相等。(4)氨水为弱碱,电离过程吸热,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量偏小;Ⅱ、(1)焓变=生成物的总能量-反应物的总能量,根据图示NO2和CO反应的热化学方程式是NO2(g) + CO(g) = CO2(g) + NO(g) △H=-(368 kJ/mol -134 kJ/mol)=-234kJ/mol;
(2) ①C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律①![]() 2+②
2+②![]() —③
—③ ![]() ,得C(s,石墨)+H2(g)= C2H2(g) △H=+226.7 kJ/mol;(3)1.3gC2H2完全燃烧生成液态水和CO2,放出62kJ热量,则2molC2H2完全燃烧生成液态水和CO2,放出2480 kJ热量,所以C2H2燃烧的热化学方程式是2C2H2(g)+5O2(g) == 4CO2(g)+2H2O(l) ΔH= -2480 kJ/mol。
,得C(s,石墨)+H2(g)= C2H2(g) △H=+226.7 kJ/mol;(3)1.3gC2H2完全燃烧生成液态水和CO2,放出62kJ热量,则2molC2H2完全燃烧生成液态水和CO2,放出2480 kJ热量,所以C2H2燃烧的热化学方程式是2C2H2(g)+5O2(g) == 4CO2(g)+2H2O(l) ΔH= -2480 kJ/mol。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A. 0.1mol·L-1Na2S溶液中:2[Na+]=[S2-]+[HS-]+[H2S]
B. 0.1mol·L-1NaHSO4溶液中:[Na+]>[SO42-]>[H+]>[OH-]
C. Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4)+2c(H2C2O4)
D. CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
SO2(g)+1/2O2(g)![]() SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g)ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
A. 196.64 kJ B. 196.64 kJ/mol C. <196.64 kJ D. >196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下图所示实验装置的 K 闭合,下列判断正确的是

A. Cu电极上发生还原反应 B. 电子沿 Zn→a→b→Cu路径流动
C. 片刻后甲池中c(SO![]() )增大 D. 片刻后可观察到滤纸b点变红色
)增大 D. 片刻后可观察到滤纸b点变红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,溶液体积均为200 ml ,开始时,电解质溶液的浓度均为0.1 mol·L-1 ,工作一段时间后,测得导线上通过了0.02 mol 电子,若不考虑溶液体积的变化,下列叙述中正确的是( )
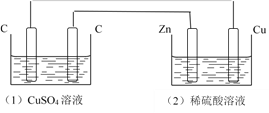
A. (1)、(2)两装置均为电解池
B. (1)、(2)溶液的PH均减小
C. (1)中阳极电极反应式为:4OH--4e-===2H2O+O2↑
D. (1)中阴极上析出0.32 g Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应是______________。在X极附近观察到的现象是______________________________。
②Y电极上的电极反应式是______________。检验该电极反应产物的方法是______________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是___________________,电极反应式是______________。
②Y电极的材料是___________________,电极反应式是______________。
(说明:杂质发生的电极反应不必写出)
③假若电路中有0.04摩尔电子通过时,阴极增重________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1799年,意大利物理学家伏特把一块锌板和一块锡板浸在盐水里,发现连接两块金属板的导线中有电流通过。下列说法正确的是( )
A.锌板是正极
B.锡板被氧化
C.盐水是电解质溶液
D.电子由锡板沿导线流向锌板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知拆开1 mol H2、1 mol O2和液态水中1 mol O—H键使之成为气态原子所需的能量分别为436 kJ、496 kJ和462 kJ;CH3OH(g)的燃烧热为627 kJ·mol-1。则CO2(g)+3H2(g)=CH3OH(g)+H2O(l) H=___________kJ·mol-1
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+ 6H2(g) ![]() CH3OCH3(g)+3H2O(l)
CH3OCH3(g)+3H2O(l)
① 该反应平衡常数表达式K=_______________。
② 已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示,该反应的H________0 (填“>”或“<”)。
若温度不变,减小反应投料比[n(H2)/n(CO2)],则K将_____(填“增大”、“减小”或“不变”)。
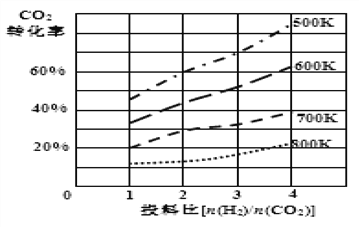
③某温度下,向体积一定的密闭容器中通入CO2(g)与H2(g)发生上述反应,当下列物理量不再发生变化时,能证明上述可逆反应达到平衡的量是__________。
A.二氧化碳的浓度 B.容器中的压强
C.气体的密度 D.CH3OCH3与H2O的物质的量之比
(3)以甲醚、空气、氢氧化钾溶液为原料的燃料电池为电源,以石墨为电极电解500mL滴有酚酞的NaCl溶液,装置如图所示:
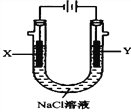
请写出电解过程中Y电极附近观察到的现象:______________,当燃料电池消耗2.8L O2(标准状况下)时,计算此时NaCl溶液的pH=________(假设溶液的体积不变,气体全部从溶液中逸出)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)指出如下图实验装置中的错误之处。(加热装置中烧杯底部已垫有石棉网)

①_____________________________________;②_______________________________________。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.玻璃棒用作引流 b.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
c.将滤纸湿润,使其紧贴漏斗壁 d.滤纸边缘高出漏斗
Ⅱ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:

(1)指出提取碘的过程中有关实验操作①和③的名称:__________;________。
(2)在3 mL碘水中,加入1mL四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________(注:试管中深色区为有色溶液),下层_____色。

Ⅲ.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

(1)欲证明滤液中存在SO42-、OH -,选用的方案是先取少量的滤液滴加________,发现溶液变红,再向其中加入________溶液,出现白色沉淀,则可证明SO42-、OH - 均存在。
(2)如何洗涤Mg(OH)2沉淀?___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com