
【题目】完成下列化学方程式,并标明反应类型.
(1)CH4+Cl2![]() _____,_____;(只写产物均为气体的一个)
_____,_____;(只写产物均为气体的一个)
(2)CH2=CH2+Br2→__________,____________;
(3)![]() +Br2
+Br2![]() _________,_____。
_________,_____。
(4)与乙烯和氢气的加成产物互为同系物的是_____(填写编号)。
a C2H2 b C6H6 c C5H12 d C2H6O
(5)请写出乙烯加聚反应方程式_________
【答案】CH3Cl、HCl 取代反应 CH2Br-CH2Br 加成反应 :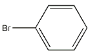 、HBr 取代反应 c
、HBr 取代反应 c 
【解析】
(1)甲烷在光照条件下与氯气发生取代反应,生成CH3Cl、CH2Cl2、CHCl3、CCl4和HCl,其中CH3Cl和HCl为气体,CH2Cl2、CHCl3、CCl4为油状液体,所以产物均为气体的反应方程式为:CH4+Cl2![]() CH3Cl+HCl,故答案为:CH3Cl、HCl;取代反应。
CH3Cl+HCl,故答案为:CH3Cl、HCl;取代反应。
(2)乙烯与溴单质发生加成反应生成1,2-二溴乙烷,其反应方程式为:CH2=CH2+Br2→CH2Br-CH2Br,故答案为:CH2Br-CH2Br;加成反应。
(3)苯与液溴在溴化铁作催化剂条件下发生取代反应生成溴苯和溴化氢,其反应方程式为: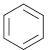 +Br2
+Br2![]()
 +HBr,故答案为:
+HBr,故答案为: 、HBr;取代反应。
、HBr;取代反应。
(4)乙烯与氢气发生加成反应生成乙烷,同系物是指结构相似,分子式之间相差若干个CH2的有机物,与乙烷互为同系物的是C5H12,故答案为:c。
(5)乙烯中含有碳碳双键,发生加聚反应生成聚乙烯,其反应方程式为: ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体0.22 mol X和气体0.16 mol Y充入5 L恒容密闭容器中,发生反应2X(g) + Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是( )
A. 该温度下此反应的平衡常数K = 72.0 L/mol
B. 反应前2 min的平均速率υ(Z) = 4.0×10-3 mol/(L·min)
C. 其他条件不变,降低温度,反应达到新平衡前υ(逆) > υ(正)
D. 其他条件不变,再充入0.1 mo1 X,新平衡时X的转化率将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A. 铁在潮湿的空气中易腐蚀
B. H2、I2、HI平衡混和气加压后颜色变深
C. 往往需要在催化剂条件下SO2氧化成SO3
D. 棕红色NO2加压后颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C三种烃,其球棍模型如下图:
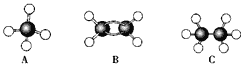
(1)等质量的以上物质完全燃烧时耗去O2的量最多的是________(填对应字母,下同);
(2)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是____________;
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
(4)在120℃、1.01×105 Pa下时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验方案合理的是( )
实验目的 | 实验设计 | |
A | 鉴别乙醇和二甲醚 | 分别取少量样品用元素分析仪进行测定 |
B | 用高锰酸钾溶液滴定未知浓度的乙二酸溶液 | 用待装液体分别润洗酸式和碱式滴定管再进行操作 |
C | 确定某无色溶液中含有 | 取少量待测液加 |
D | 鉴别 | 分别滴加氨水至过量,观察现象 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中的四种元素![]() 的有关信息如下,请用合理的化学用语填写空白。
的有关信息如下,请用合理的化学用语填写空白。
在周期表中的区域 | 元素代号 | 有关信息 |
短周期元素 |
|
|
|
| |
长周期元素 |
|
|
|
|
(1)![]() 元素周期表中的位置为___________,
元素周期表中的位置为___________,![]() 、
、![]() 、
、![]() 三种元素的简单离子半径从大到小的顺序为__________。
三种元素的简单离子半径从大到小的顺序为__________。
(2)足量![]() 的最高价氧化物的水化物的稀溶液与
的最高价氧化物的水化物的稀溶液与![]() 甲完全反应,放出热量
甲完全反应,放出热量![]() ,请写出表示该过程中和热的热化学方程式____________。
,请写出表示该过程中和热的热化学方程式____________。
(3)下列有关![]() 的气态氢化物丁的说法正确的有_____________(选填字母)
的气态氢化物丁的说法正确的有_____________(选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性强 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________;乙的水溶液呈酸性,请写出离子方程式解释原因_____________。
(5)![]() 是一种弱酸,请写出它的电离方程式__________________;
是一种弱酸,请写出它的电离方程式__________________;![]() 溶液有剧毒,可以用
溶液有剧毒,可以用![]() 溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,
溶液进行无毒化处理,请写出二者反应的化学方程式__________________;室温下,![]() 的电离常数
的电离常数![]() ,在
,在![]() 的
的![]() 溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的
溶液中滴加同浓度盐酸至溶液呈中性,此时溶液中的 _____________。
_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按如图所示装置进行实验,并回答下列问题:

(1)甲池,通入CH3OH(甲醇)的电极反应式为______________________。
(2)乙池中的总反应化学方程式为______________________。
(3)当甲池中消耗O20.56L(标准状况下)时,理论上乙池中B极的质量增加__________g;此时丙装置中___________(填“c”或“d”)电极折出1.20g金属,则按丙装置中的的某盐溶液可能是__________________(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
Ⅱ.SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控利和治理是优化我们生存环境的有效途径。

(4)利用化学原理将C0、SO2转化为重要化工原料,装置如图所示:
①若A为CO,B为H2,C为CH3OH,则通入CO一极为____________________极。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为____________________。
③若A为NO2,B为O2,C为HNO3,则正极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个反应:a.NaOH+HCl=NaCl+H2O b.Cu+2Ag+ =Cu2+ +2Ag
(1)反应____(填字母)不能设计成原电池。原因是__________________________。
(2)a反应为______反应(填“放热”或“吸热”),NaOH和HCl的总能量________(填“大于”“小于”或“等于”)NaCl和H2O的总能量。
(3)已知HCl中H-Cl键的键能为431 kJ·mol-1,则断开1molH-Cl键_____431 kJ的能量,形成1molH-Cl键_____431 kJ的能量。(填“吸收”或“放出”)
(4)反应____(填字母)能设计成原电池,请画出实验装置图,注明电极材料和电解质溶液。__________

写出电极反应式及反应类型
正极反应式:_____________________,
反应类型:_______________________,
负极反应式:_____________________。
(5)上题所设计原电池中,向正极移动的离子为_______,电池工作一段时间后,电解质溶液质量减轻7.6g,正极增重的质量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 有如图所示的转化关系,则 X、W可能的组合有()
![]()
①C、O2②Na、O2③Fe、HNO3④S、O2⑤N2、O2⑥H2S、O2⑦NH3、O2
A.四项B.五项C.六项D.七项
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com