
【题目】氢、氮、氧、硫,镁,铁、铜,锌等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)某同学根据已学知识,推断Mg基态原子的核外电子排布为,
![]()
该同学所画的电子排布图违背了________________________________.
(2)Fe位于___________族_______区,Fe2+价电子排布式为_____________。
(3)MgCO3的分解温度____ BaCO3 (填“>” 或、“<”)
(4)C、N、O元素的第一电离能由大到小的顺序为_________________
(5)1mol[Cu(NH3)2]+中含有σ键的数目为___________
(6)下列有关说法不正确的是____。
A.热稳定性:NH3 >PH3,原因是NH3分子间存在氢键,而PH3分子间存在范德华力
B.SO2与CO2的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点: SiF4< SiCl4< SiBr4 <SiI4 , 原因是分子中共价键键能逐渐增大
D.熔点: CaO > KCl > KBr,原因是晶格能逐渐减小
(7)晶体Cu的堆积方式如图所示,其中Cu原子在二维平面里放置时的配位数为_________,设Cu原子半径为a,晶体的空间利用率为______。(用含π,a、的式子表示,不必化简)

【答案】泡利原理 第Ⅷ族 d 3d6 < N>O>C 8 mol(或8×6.02×1023) AC 6 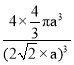 ×100%或者
×100%或者![]() ×100%
×100%
【解析】
(1)泡利原理:一个原子轨道上最多可容纳两个电子,而这两个电子的自旋方向必须相反;
(2)铁是26号元素,据此解答;铁原子在失电子时,先失去最外层的两个4s电子。
(3)为同主族元素的离子,从上到下,离子半径逐渐增大,半径越大,分解温度越高,越不易分解,相反,阳离子半径越小,越容易分解;
(4)同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(5)单键均为σ键,双键中有1个σ键和一个π键,配位键也属于σ键;
(7)铜原子在二维平面里放置为密致层,晶体空间利用率为![]() ×100%。
×100%。
(1)如图所示的电子排布图中3s轨道有两个自旋方向一样的电子,违反了泡利原理,
故答案为:泡利原理;
(2)Fe位于第Ⅷ族族d区,铁原子核外电子排布式为:1s22s22p63s23p63d64s2,去4s能级2个电子形成Fe2+,可知Fe2+基态核外电子排布式为1s22s22p63s23p63d6,Fe2+的价电子排布式为:3d6,
故答案为:第Ⅷ族;d; 3d6;
(3)为同主族元素的离子,从上到下,离子半径逐渐增大,半径越大,分解温度越高,越不易分解,相反,阳离子半径越小,越容易分解,镁与钡同主族,所以BaCO3比MgCO3分解温度高,
故答案为:<;
(4)同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
故答案为:N>O>C
(5)1个[Cu(NH3)2]+中6个N—H单键,2个配位键,所以1mol[Cu(NH3)2]+中含有σ键的数目为8 mol(或8×6.02×1023),
故答案为:8 mol(或8×6.02×1023);
(6)A.热稳定性:NH3 >PH3,原因是氮氢键比磷氢键键能更大,故A错误;
B.SO2与CO2的化学性质有些类似,SO2为sp2杂化,平面三角形,CO2的为sp杂化,直线型,故B正确;
C.SiF4、SiCl4、SiBr4、SiI4都是分子晶体,影响熔、沸点高低的因素是分子间作用力或氢键,不是化学键影响。故C错误;
D.CaO、KCl、KBr都是离子晶体,影响熔、沸点高低的主要因素离子键,离子键强弱用晶格能来衡量,离子键越强晶格能越大。CaO的阴阳离子半径小、所带电荷多,所以离子键最强,晶格能最大;KBr的阴阳离子半径大、所带电荷少,所以离子键最弱,晶格能最小,故D正确,
故答案为:AC;
(7)铜原子在二维平面里放置为密致层,故配位数为6;设Cu原子半径为a,每个面对角线上的三个Cu原子紧密相连,所以晶胞棱长=2![]() a,晶胞体积=(2
a,晶胞体积=(2![]() a)3,该晶胞中Cu原子个数8×1/8+6×1/2=4。晶体空间利用率为
a)3,该晶胞中Cu原子个数8×1/8+6×1/2=4。晶体空间利用率为![]() ×100%=
×100%= ,
,
故答案为:6;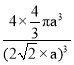 ×100%或者
×100%或者![]() ×100%。
×100%。


科目:高中化学 来源: 题型:
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如图,下列说法正确的是( )
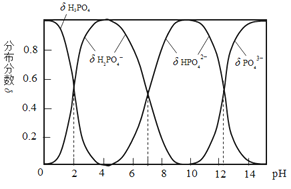
A.H3PO4的电离方程式为:H3PO4![]() 3H++ PO43
3H++ PO43
B.pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4、HPO42、PO43
C.滴加NaOH溶液至pH=7,溶液中c(Na+)= c(H2PO4)+2c(HPO42)+3c(PO43)
D.滴加少量Na2CO3溶液,3Na2CO3+2H3PO4 =2Na3PO4+3H2O+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了确认乙酸、碳酸和硅酸的酸性强弱,有人设计用如图所示装置,一次实验达到目的(不能再选用其他酸性溶液)。

(1)锥形瓶内装有某种可溶性正盐固体(含有3种酸的酸根的其中一种),此固体为________,分液漏斗中所盛试剂是___。
(2)装置B中所盛试剂的名称是________,试剂的作用是__________。
(3)装置C中出现的现象是__________________。
(4)由实验可知三种酸的酸性大小顺序为________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )

A.NO2、N2B.NO、CO2
C.NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧硫化碳(COS,结构类似于CO2)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。有多种方法可以脱氧硫化碳中的硫,其中氢解和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g) + H2(g)H2S(g) + CO(g) ΔH1= + 7kJ/mol
②水解反应:COS(g) + H2O(g)H2S(g) + CO2(g) ΔH2= -35 kJ/mol
请回答下列问题:
(1)氧硫化碳的电子式为____________。
(2)CO2和H2能反应生成CO和H2O(g),写出该反应的热化学方程式______________。
(3)在密闭恒温(高于100℃)恒容装置中进行水解反应,下列能说明达到平衡状态的是___________________。
A.混合气体密度不再改变 B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变 D. COS(g) 的浓度不变
(4)①上述氢解反应的平衡常数K随温度降低而________(填“增大”或“减小”)。
②某温度下,体积为2L的恒容体系中,物质的量分别为m mol、n mol的COS蒸气和H2气发生氢解,已知COS的转化率为α,则该温度下的平衡常数K=___________(用m、n、α等符号表示)。
(5)某科研小组研究改进催化剂TiO2/Al2O3和温度对COS水解的影响,得到如图图像:
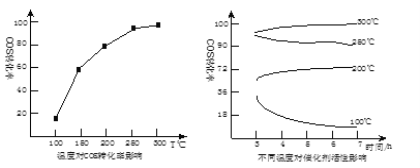
COS水解的最佳温度是 __________ ;理由是 ________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将6体积的NO2(不考虑N2O4)和一定体积的NO置于试管中,并将试管倒置于水中,当通入4.5体积的O2充分反应后,剩余1.5体积气体,则原NO体积可能为( )
①3体积 ②4体积 ③5体积 ④5.5体积 ⑤2体积
A.③B.⑤C.④或⑤D.②或⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示,下列说法正确的是( )
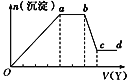
A.若Y是盐酸,则Oa段转化为沉淀的离子(上表中,下同)只有[Al(OH)4]-
B.若Y是盐酸,则溶液中可能含有的阳离子是Al3+
C.若Y是NaOH溶液,则bc段反应的离子方程式为Al(OH)3+OH-=[Al(OH)4]-
D.若Y是NaOH溶液,则X溶液中只存在四种离子,是Al3+、Fe3+、NH4+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,将一根较纯的铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重。下列关于此现象的说法错误的是( )
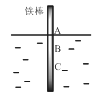
A.该腐蚀过程属于电化腐蚀
B.铁棒AB段电极反应为O2 + 2H2O+ 4e-→ 4OH-
C.铁棒AB段是负极,BC段是正极
D.产生此现象的根本原因是铁棒所处化学环境的不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图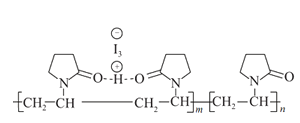 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com